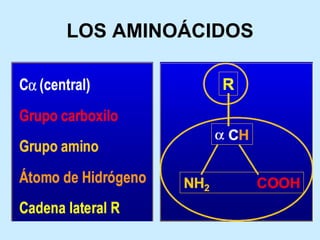
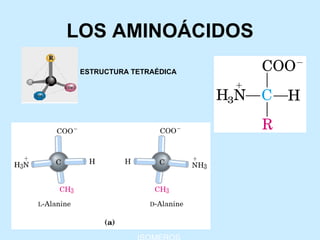
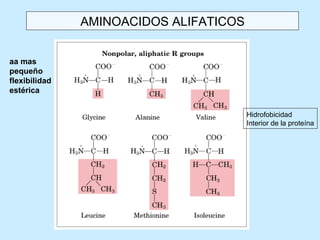
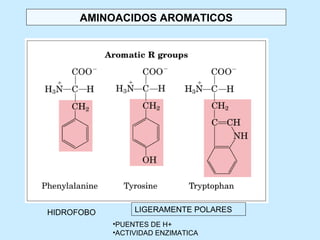
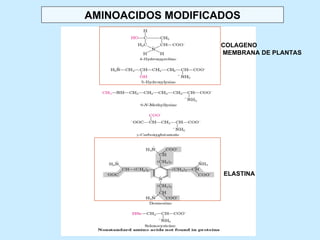
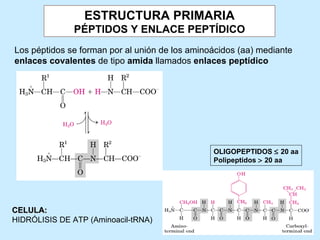
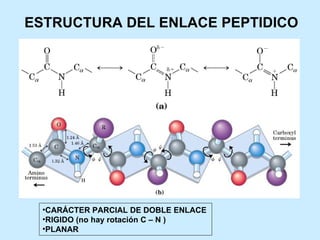
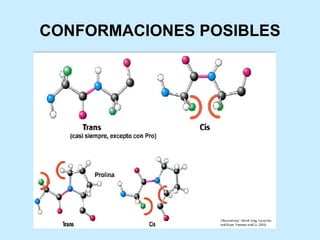
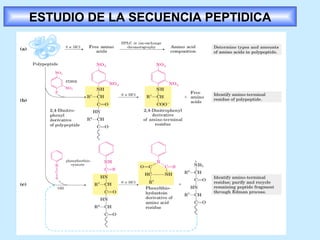
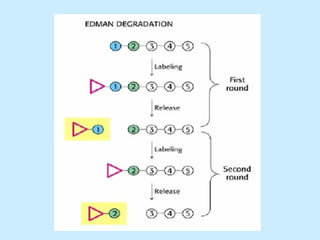
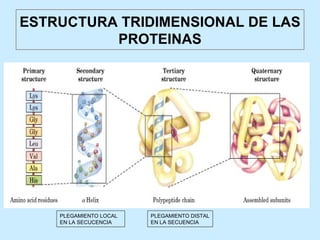
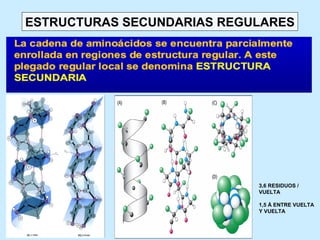
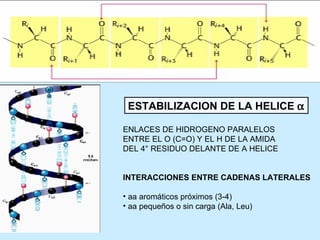
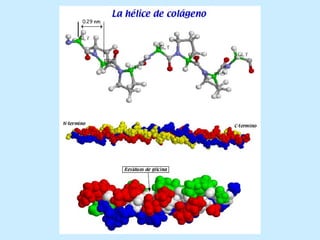
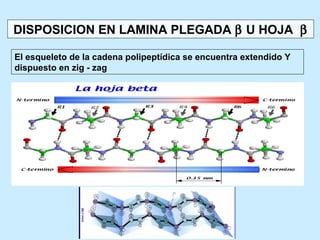
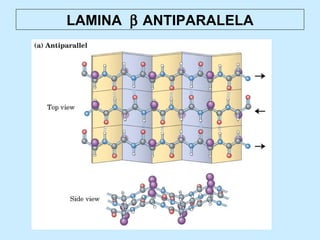
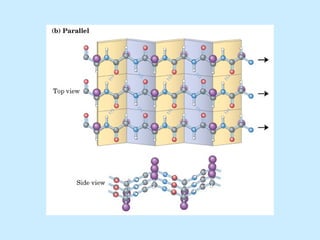
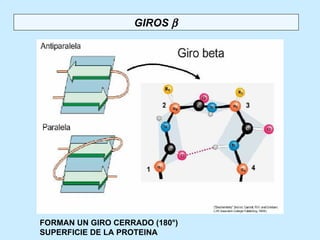
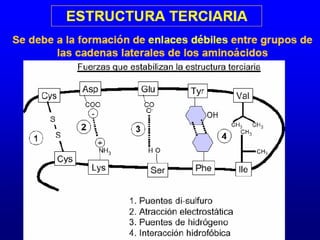
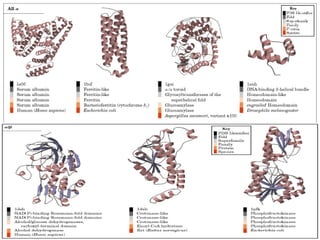
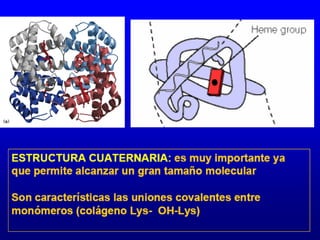
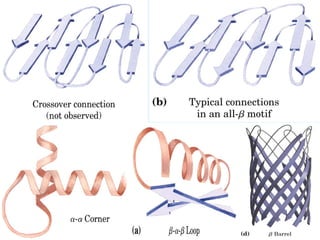
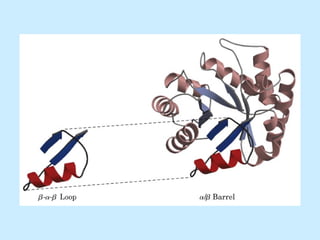
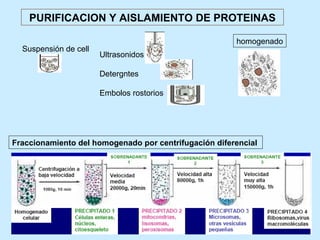
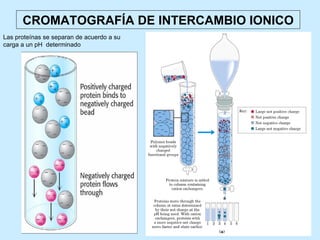
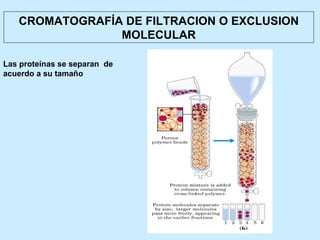
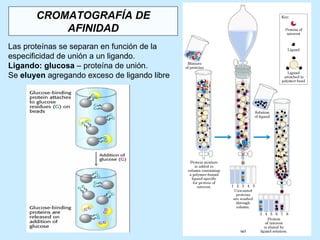
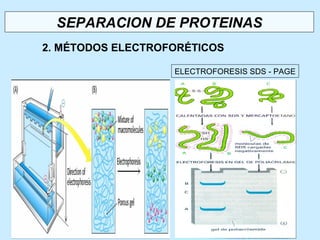
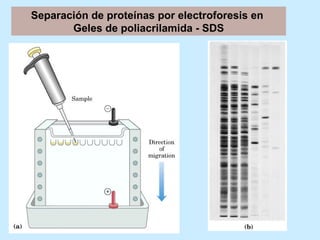
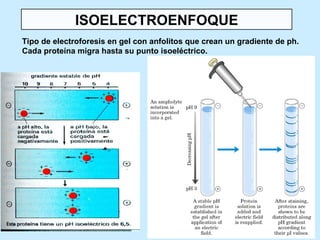
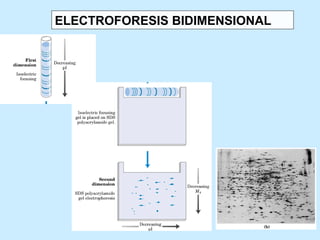
Este documento describe la estructura de las proteínas. Explica que están compuestas por aminoácidos unidos por enlaces peptídicos para formar cadenas polipeptídicas. Luego se pliegan en estructuras secundarias como hélices alfa y láminas beta que forman la estructura terciaria tridimensional funcional de la proteína. También se detalla cómo se purifican y separan las proteínas utilizando métodos como cromatografía y electroforesis.