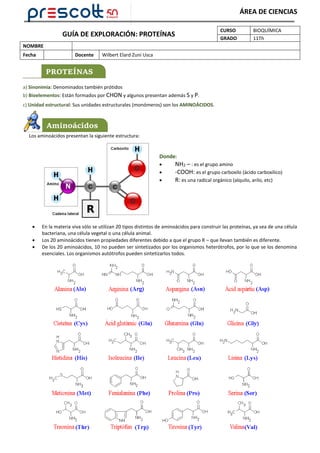
Las proteínas están formadas por cadenas de aminoácidos unidos por enlaces peptídicos. Existen 20 tipos de aminoácidos que se combinan en diferentes secuencias para formar las proteínas. Las proteínas tienen estructura primaria, secundaria, terciaria y en algunos casos cuaternaria. La estructura primaria es la secuencia de aminoácidos, la secundaria es el enrollamiento en hélice alfa o lámina beta, la terciaria es la forma globular tridimensional y la cuaternaria implica cadenas múlt