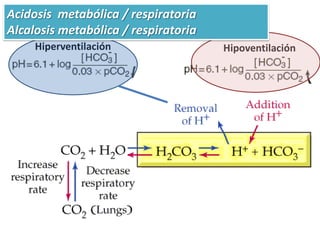
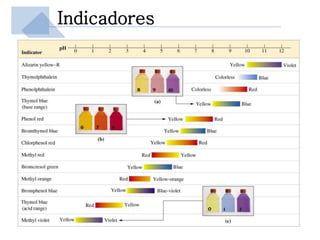
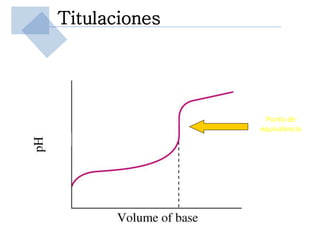
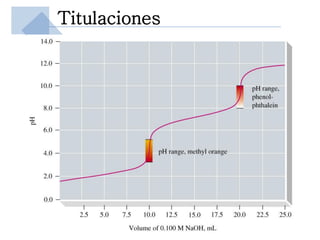
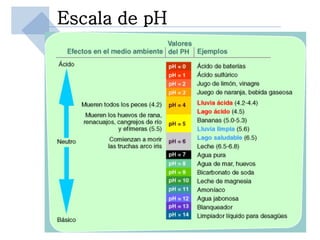
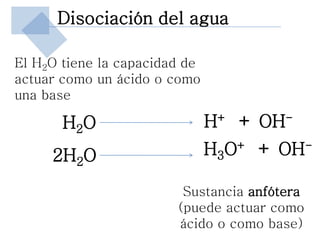
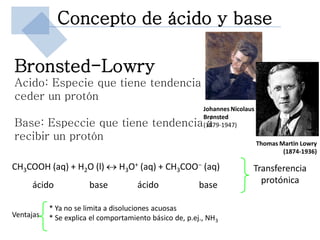
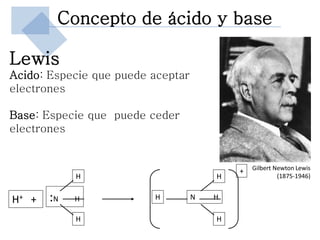
Este documento trata sobre conceptos básicos de acidez y pH. Explica la escala de pH, la disociación del agua y su comportamiento anfótero. Define los conceptos de ácido y base según las teorías de Arrhenius, Bronsted-Lowry y Lewis. Describe la constante de ionización del agua (Kw) y su relación con pH y pOH. Finalmente, introduce conceptos como ácidos y bases fuertes y débiles, y constante de disociación, así como indicadores de pH y titulaciones ácido-base.


![Equilibrio de ionización
Kw= constante de equilibrio iónico
A 25ºC:
Kw = [H3O+][OH-]
[H+]= 1x10-7
Kw = [1x10-7][1x10-7]
[OH-]= 1x10-7
Kw = 1x10-14
- log 10-14 = - log [H3O+] - log [OH-]
14 = pH + pOH](https://image.slidesharecdn.com/phypkpbcm-130331225504-phpapp02/85/pH-y-pK-7-320.jpg)
![Equilibrio de ionización
pH = - log [H3 O+] Agua pura: [H3O+] = [OH-] ;
[H3O+] = 10-7 pH = 7
pOH = - log [OH-]
[OH-] = 10-7 pOH = 7
DISOLUCIÓN DISOLUCIÓN DISOLUCIÓN
ÁCIDA NEUTRA BÁSICA
[H3O+] > [OH-] [H3O+] = [OH-] [H3O+] < [OH-]
pH < 7 pH = 7 pH > 7
7
ácida básica
pH](https://image.slidesharecdn.com/phypkpbcm-130331225504-phpapp02/85/pH-y-pK-8-320.jpg)