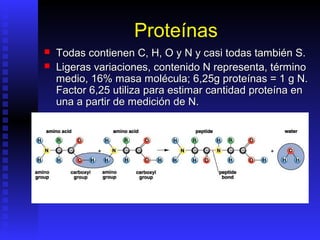
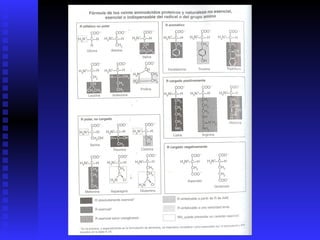
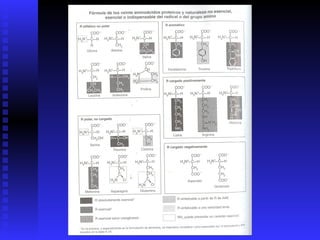
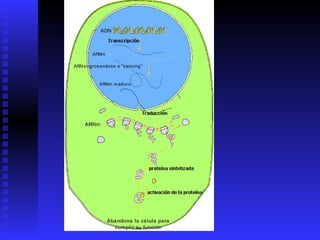
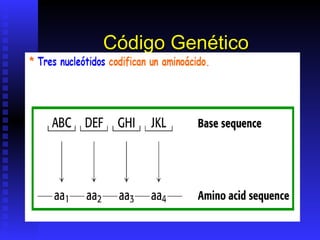
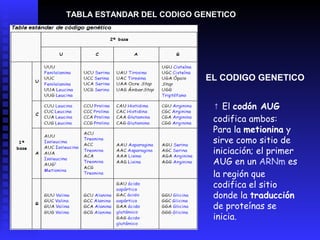
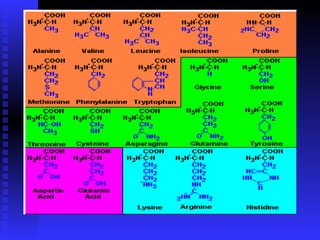
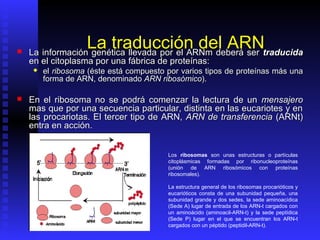
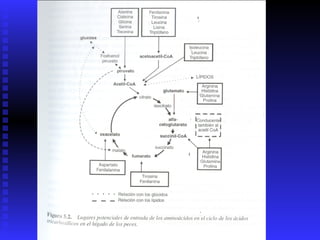
Las proteínas son moléculas constituidas por la unión de aminoácidos a través de enlaces peptídicos. Existen 20 aminoácidos diferentes que forman las proteínas. Las proteínas son sintetizadas en la célula a través de la transcripción del ADN en ARNm y la posterior traducción del ARNm en el ribosoma. En los peces, los aminoácidos son una importante fuente de energía y la mayor parte de los aminoácidos catabolizados se excretan como amonio a través de las branquias y la or