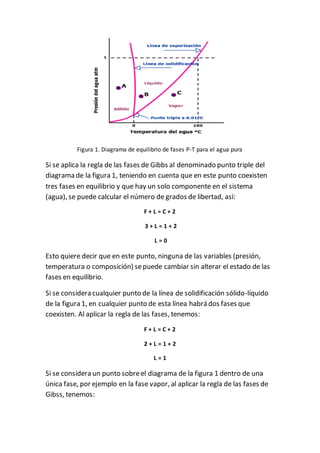
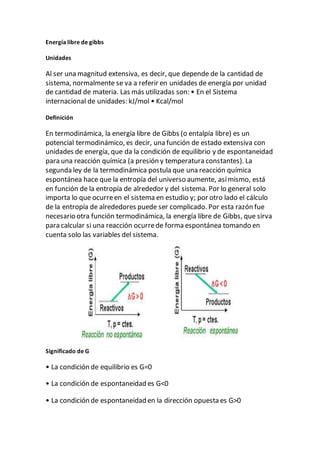
Este documento describe los diagramas de fase, incluyendo su definición, componentes y tipos. Explica que los diagramas de fase muestran las condiciones de equilibrio termodinámico de un sistema en función de la temperatura, presión y composición. También describe puntos e información clave que se pueden obtener de los diagramas de fase binarios y de un componente.