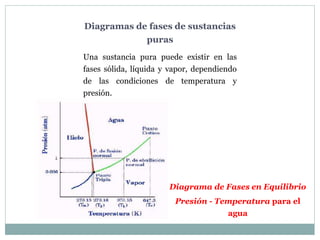
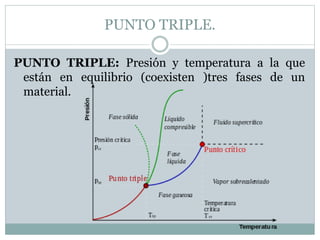
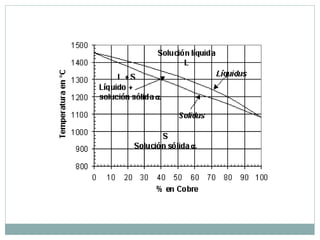
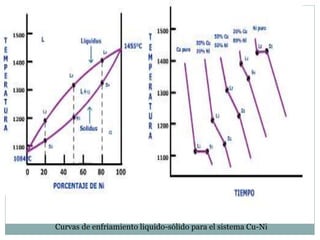
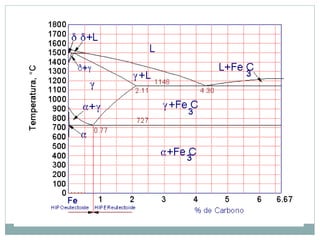
Este documento proporciona una introducción a los diagramas de fases. Explica que un diagrama de fases muestra las fases presentes en un sistema de materiales a diferentes temperaturas y composiciones. También describe conceptos clave como puntos triples y la regla de Gibbs para determinar el número máximo de fases en equilibrio. Por último, presenta ejemplos de diagramas de fases comunes como los sistemas binarios isomorfos y el diagrama hierro-carbono.