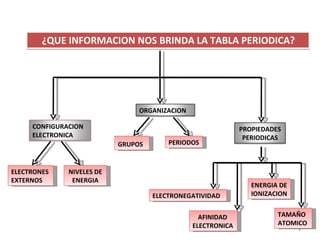
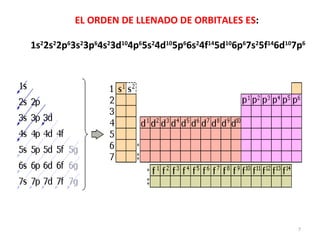
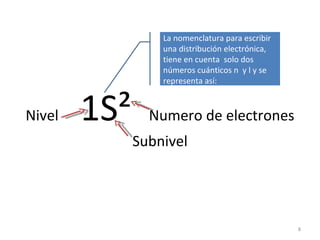
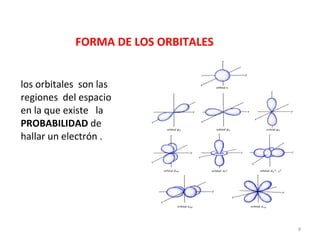
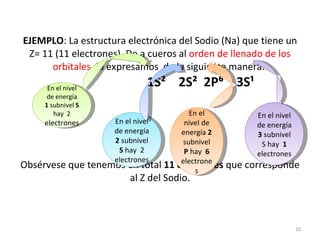
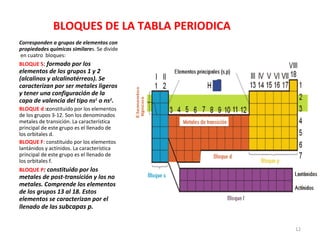
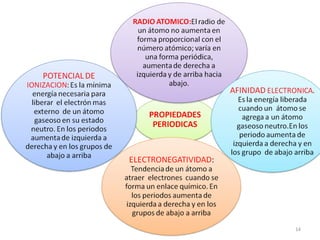
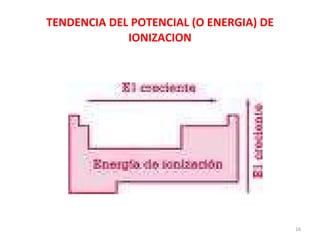
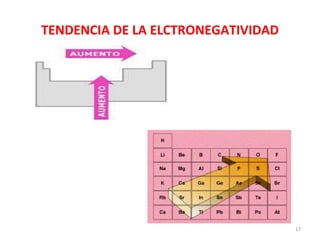
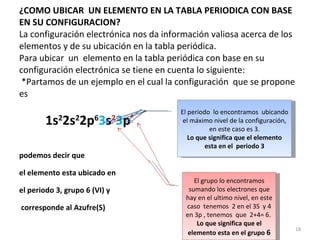
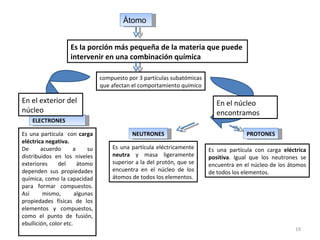
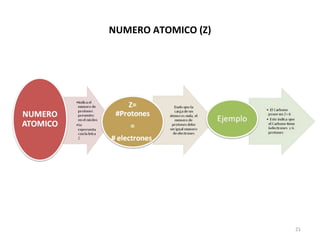
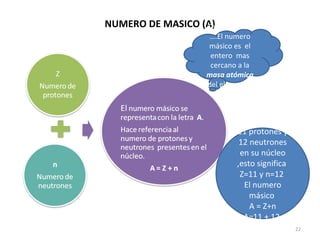
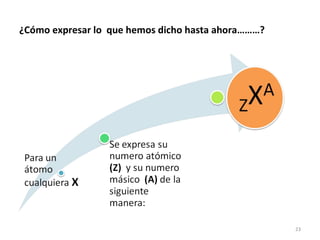
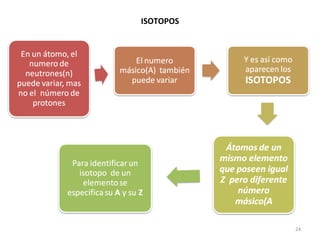
El documento explica los conceptos fundamentales de la configuración electrónica, incluyendo el orden de llenado de orbitales, los principios de Aufbau y Pauli, y cómo usar la configuración electrónica para ubicar un elemento en la tabla periódica. También describe los grupos y períodos de la tabla, así como propiedades periódicas como el radio atómico y la electronegatividad.