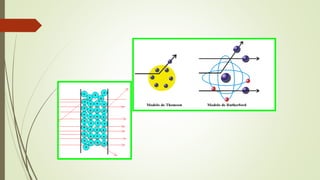
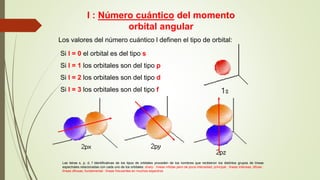
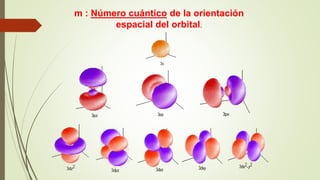
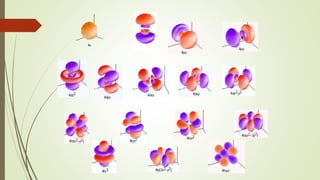
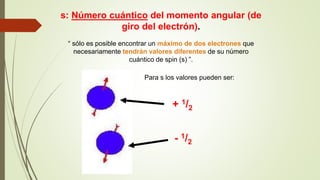
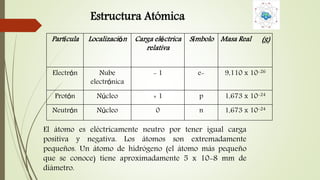
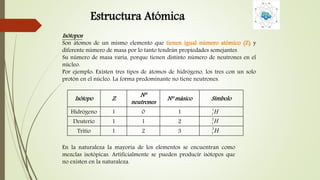
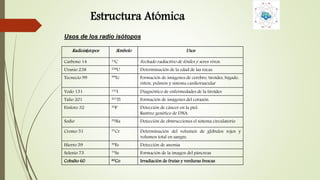
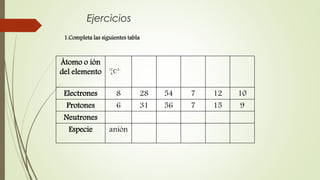
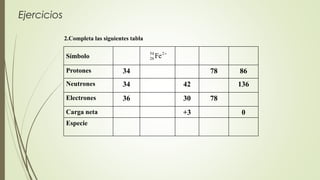
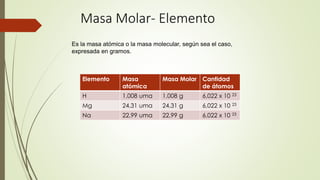
El documento describe la estructura atómica desde diferentes modelos históricos hasta la teoría moderna. Explica que un átomo está formado por un núcleo central positivo rodeado de electrones, y describe los números cuánticos que definen la configuración electrónica. También define conceptos como isótopos, iones y masa atómica.