conocer los modelos atómicos a traves de diversos ejemplos y características
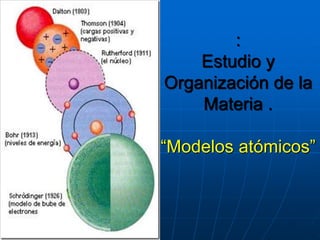
- 1. : Estudio y Organización de la Materia . “Modelos atómicos”
- 2. Objetivo del tema : Investigar y analizar como ha evolucionado el conocimiento de la materia, considerando los aportes y evidencias de: Teoría atómica de Dalton, Modelos atómicos desarrollados por Thomson, Rutherford y Bohr.
- 3. OBJETIVO DE LA CLASE Describir la teoría atómica de Dalton mediante sus postulados y evidencia previa sobre la materia. Identifican el modelo atómico de Thomson como producto de la evolución del concepto átomo con su hipótesis, experimentos y postulados.
- 4. En el siglo V a. C., Leucipo (450-370 a. C.) y su discípulo Demócrito (460- 370 a. C.) postularon la idea de que la materia era discontinua, es decir, que se podía dividir solo hasta cierto punto, ya que estaba formada por diminutas partículas a las que llamó átomos. (a=sin; tomos=división). Hacia un modelo atómico… Este pensamiento griego no tuvo aceptación, ya que contradecía las ideas de otros filósofos como Aristóteles y Empédocles, quienes afirmaban que la materia estaba formada por cuatro elementos: aire, fuego, tierra y agua, que se combinaban.
- 5. En 1808, John Dalton publicó sus ideas sobre el modelo atómico de la materia Los principios fundamentales de esta teoría son: 1. La materia está formada por minúsculas partículas indivisibles llamadas átomos. 2. Hay distintas clases de átomos que se distinguen por su masa y sus propiedades. (1766-1844)
- 6. 3.Los compuestos se forman al combinarse los átomos de dos o más elementos en proporciones fijas y sencillas. 4.En las reacciones químicas, los átomos se intercambian de una a otra sustancia, pero ningún átomo de un elemento desaparece ni se transforma en un átomo de otro elemento.
- 7. Para representar sus postulados, Dalton ideó una serie de símbolos circulares, los cuales representaban los átomos de los elementos. Estos símbolos, al combinarse, representaban los compuestos químicos. Aunque con el paso de los años, y de acuerdo a las nuevas evidencias experimentales acerca de los fenómenos eléctricos, se llegó a determinar que los átomos eran divisibles.
- 8. 1897 : Joseph Thomson Experimentando en un tubo de descarga, observó que con el paso de corriente eléctrica se producían unos rayos de luz dentro del tubo, a los cuales llamó rayos catódicos. Con esta experiencia demostró que los rayos eran haces de partículas con carga negativa, a los que llamó electrones (e–): primeras partículas subatómicas confirmadas experimentalmente. (1856-1940)
- 9. 1897 J.J. Thomson Demostró que dentro de los átomos hay unas partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones. De este descubrimiento dedujo que el átomo debía de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones. BUDÍN DE PASAS Finalizando el siglo XIX, y utilizando un tubo con cátodo perforado, Eugen Goldstein (1850-1930) descubre la existencia de las partículas subatómicas de carga positiva, ya previstas por Thomson. A estas las llamó protones (p+).
- 10. Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas alfa (núcleos de helio). Observaban, mediante una pantalla fluorescente, en qué medida eran dispersadas las partículas. La mayoría de ellas atravesaba la lámina metálica sin cambiar de dirección; sin embargo, unas pocas eran reflejadas hacia atrás con ángulos pequeños. Con la idea de conocer aun más la estructura interna del átomo. Ernest Rutherford (1871-1937)
- 11. Éste era un resultado completamente inesperado, incompatible con el modelo de átomo macizo existente. Rutherford demostró que la dispersión era causada por un pequeño núcleo cargado positivamente, situado en el centro del átomo de oro. De esta forma dedujo que la mayor parte del átomo es espacio vacío Observe que solo cuando el rayo choca con el núcleo del átomo hay desviación.
- 12. Las partículas desviadas de la lámina de oro fueron denominadas protones Estos resultados y el posterior descubrimiento del neutrón, por Chadwick, llevaron a Rutherford a postular un nuevo modelo atómico conocido como modelo planetario.
- 13. 1911 : E. Rutherford
- 14. El modelo atómico de Rutherford explica la naturaleza de la carga neutra de los átomos, pero no puede explicar la masa total del átomo. H : contiene 1 protón He: contiene 2 protones Según el modelo la relación debía ser: He / H = 2 / 1 ¡¡Pero en realidad es 4/1!!
- 15. Rutherford y otros investigadores propusieron que debía existir otra partícula subatómica en el núcleo, que fuera neutra y con una masa aproximada a la del protón. A la que llamó neutrón. Chadwick en 1932, mediante una reacción nuclear detectó una partícula con estas características.
- 16. Nube alrededor del núcleo…
- 17. En el átomo entonces encontramos… TAREA: Investigar como se determinaron la masa y carga de cada una de las partículas subatómicas.
- 18. Actividad Nº1 Copia las siguientes frases y completa con los concepto claves. Las partículas subatómicas negativas son los….……. Las partículas subatómicas positivas son los …….. Los átomos son eléctricamente ……. es decir, tienen la misma cantidad de protones y electrones. La representación que describe la estructura de un átomo se llama …..
- 19. 1913: Niels Bohr (1885-1962) Rutherford al postular su modelo no tuvo en cuenta algunas investigaciones previas sobre la constitución del átomo y experimentaciones sobre la luz emitida o absorbida por las sustancias, las cuales indicaban algunos errores en su teoría. Uno de los errores del modelo atómico de Rutherford era postular que los electrones se encuentran girando alrededor del núcleo y permanecen en estas órbitas. Tomando en cuenta estas observaciones, Niels Bohr planteó un nuevo modelo atómico, basado en el átomo de Hidrógeno el cual indicaba…
- 20. Postulados de Bohr 1. Los electrones giran en órbitas fijas y definidas, llamadas niveles de energía. 2. Los electrones que se encuentran en niveles de energía más cercanos al núcleo poseen menos energía que los que se encuentran lejos de él.
- 21. Postulados de Bohr 3. Cuando el electrón se encuentra en una órbita determinada no emite ni absorbe energía. 5. Si el electrón regresa a un nivel menor, debe emitir energía en forma de luz (Radiación electromagnética). 4. Si el electrón absorbe energía de una fuente externa, puede “saltar” a un nivel mayor de energía.
- 22. En realidad … La teoría atómica de Bohr explicaba perfectamente los espectros de emisión monoelectrónicos como el del hidrógeno, He+, Li+. Sin embargo el modelo de Bohr fallaba al intentar explicar los espectros de atómos polielectrónicos.
- 24. Principio de dualidad onda-partícula. Hipótesis planteada en 1924 por el científico francés Louis Broglie representa el inicio de la mecánica cuántica moderna. De Broglie plantea que las partículas materiales, en especial los electrones, deberian tener comportamiento dual onda- particula como la luz.
- 25. Entonces… La mecánica cuántica señala que es imposible describir el movimiento de los electrones según trayectorias y que solo podemos determinar la probabilidad de encontrar un electrón cualquiera en un lugar del espacio. Este es el “Principio de Incertidumbre de Heisenberg”.
- 26. MODELO MECANO- CUANTICO: Erwin Schrödinger : Plantea concepto de orbital. El cual es una región del espacio donde hay una alta probabilidad de encontrar un electrón
- 28. FIN