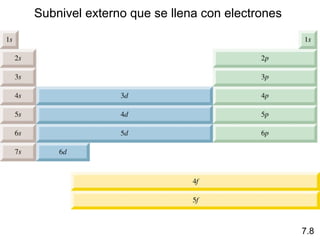
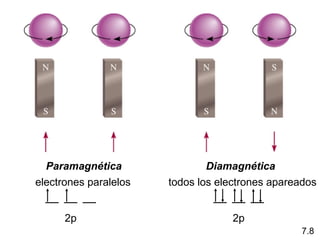
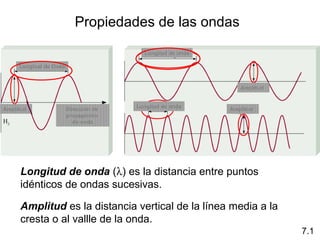
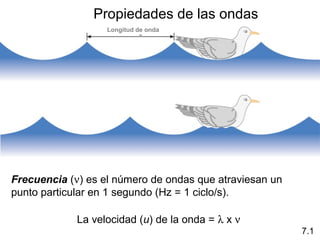
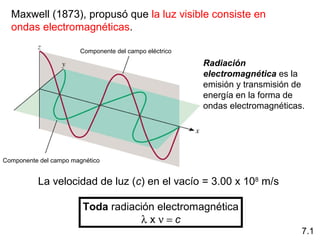
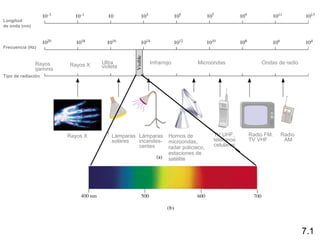
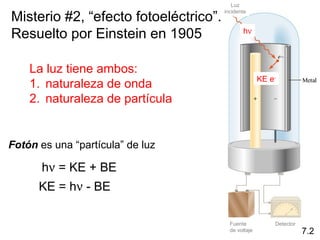
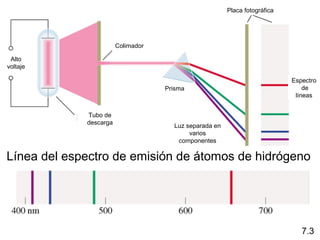
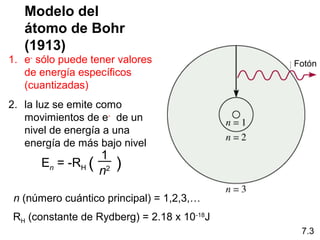
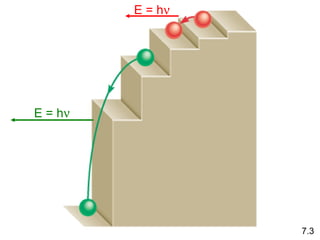
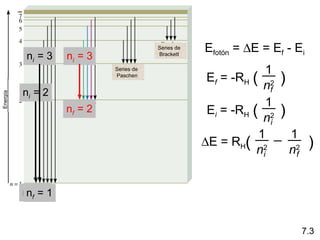
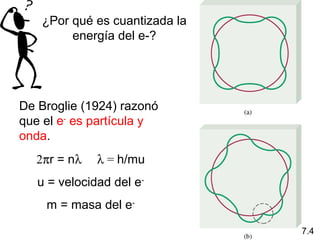
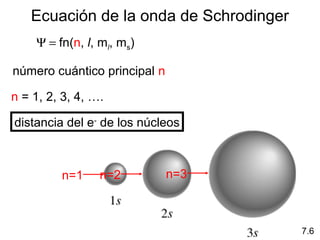
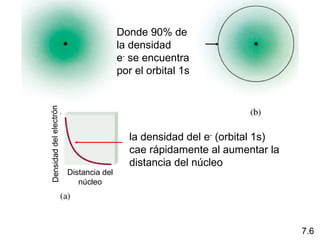
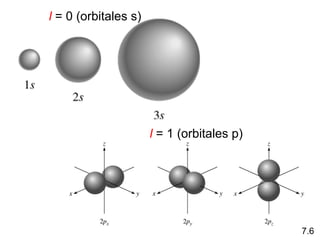
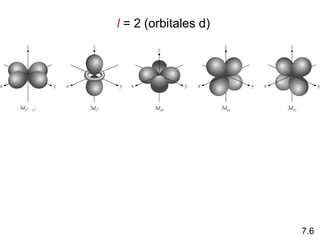
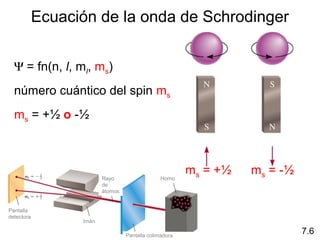
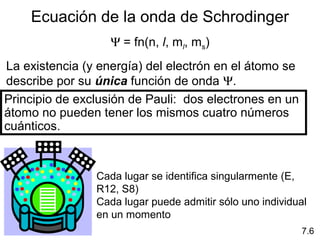
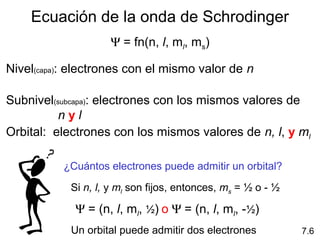
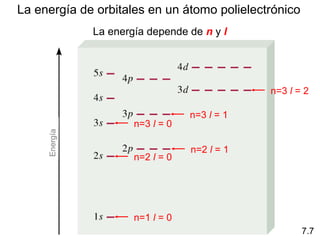
1) El documento describe las propiedades de las ondas electromagnéticas y cómo la teoría cuántica explica la estructura electrónica de los átomos. 2) Explica que la luz tiene naturaleza de onda y partícula y que los electrones solo pueden tener valores de energía específicos. 3) Detalla cómo la ecuación de Schrödinger describe la probabilidad de encontrar electrones y predice los números cuánticos que definen los orbitales atómicos.








![¿Cuál es la configuración electrónica del Mg?
Mg 12 electrones
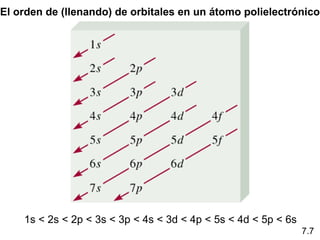
1s < 2s < 2p < 3s < 3p < 4s
1s2
2s2
2p6
3s2
2 + 2 + 6 + 2 = 12 electrones
7.7
Abreviado como [Ne]3s2
[Ne] 1s2
2s2
2p6
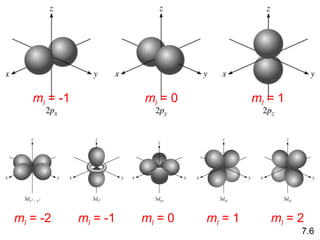
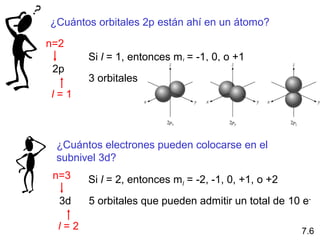
¿Cuáles son los números cuánticos posibles
para el último (externo) electrón en Cl?
Cl 17 electrones 1s < 2s < 2p < 3s < 3p < 4s
1s2
2s2
2p6
3s2
3p5
2 + 2 + 6 + 2 + 5 = 17 electrones
En último electrón sumado al orbital 3p
n = 3 l = 1 ml = -1, 0, o +1 ms = ½ o -½](https://image.slidesharecdn.com/cunticayestructuraelectrnica1-150227194334-conversion-gate01/85/Cuantica-y-estructura-electronica1-32-320.jpg)