El documento describe los biocatalizadores o enzimas. Las enzimas son proteínas producidas por las células que actúan como catalizadores para acelerar las reacciones químicas dentro de las células sin dañar a la célula. Las enzimas se unen específicamente a moléculas llamadas sustratos y los convierten en productos. Las enzimas pueden catalizar miles de millones de reacciones por minuto y son reutilizables. Factores como la temperatura, el pH y la concentración de sustrato afectan la































![ECUACIÓN DE MICHAELIS-MENTEN
Vo = V max [S]
Km + [S]](https://image.slidesharecdn.com/enzimas-clase-151009141439-lva1-app6892/85/Enzimas-clase-33-320.jpg)



![Determinación Cuantitativa de la Cinética Enzimática
1. La reacción global
2. Procedimeinto analítico para determinar elS que desaparece o el P
que aparece
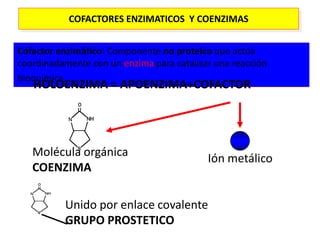
3. Sí el E requiere Cofactores (iónes o coenzimas)
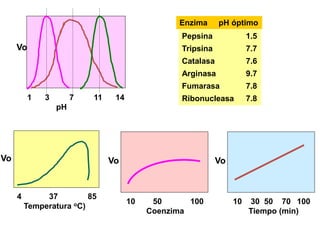
4. La dependencia de la actividad enzimática con la [S] o se la KM del
S.
5. El pH óptimo
6. Un intervalo de temperatura en la que la E es estable y muestra
actividad elevada.](https://image.slidesharecdn.com/enzimas-clase-151009141439-lva1-app6892/85/Enzimas-clase-37-320.jpg)






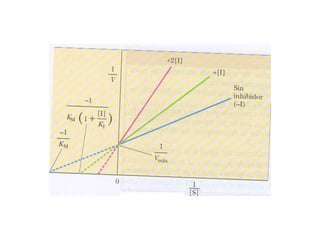
![Cuando:
Vo= Vmax Todos los sitios activos están
ocupados y no hay moléculas de E libre.
KM= [S] Sí... ½ Vmax
KM representa la cantidad de sustrato
necesaria para fijarse a la mitad de la E
disponible y producir la mitad de la Vmax
KM representa la concentración del sustrato
en una célula](https://image.slidesharecdn.com/enzimas-clase-151009141439-lva1-app6892/85/Enzimas-clase-45-320.jpg)