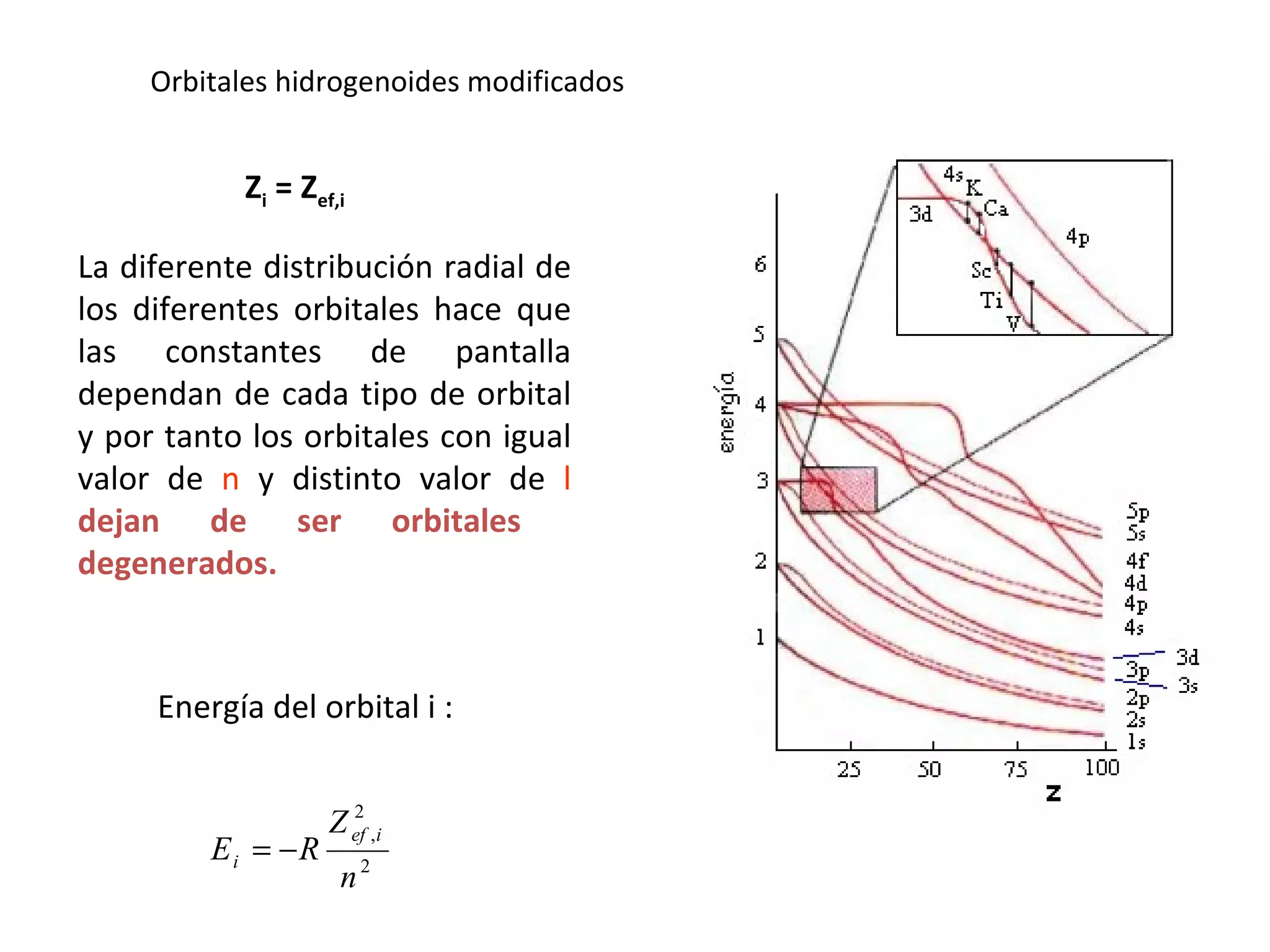
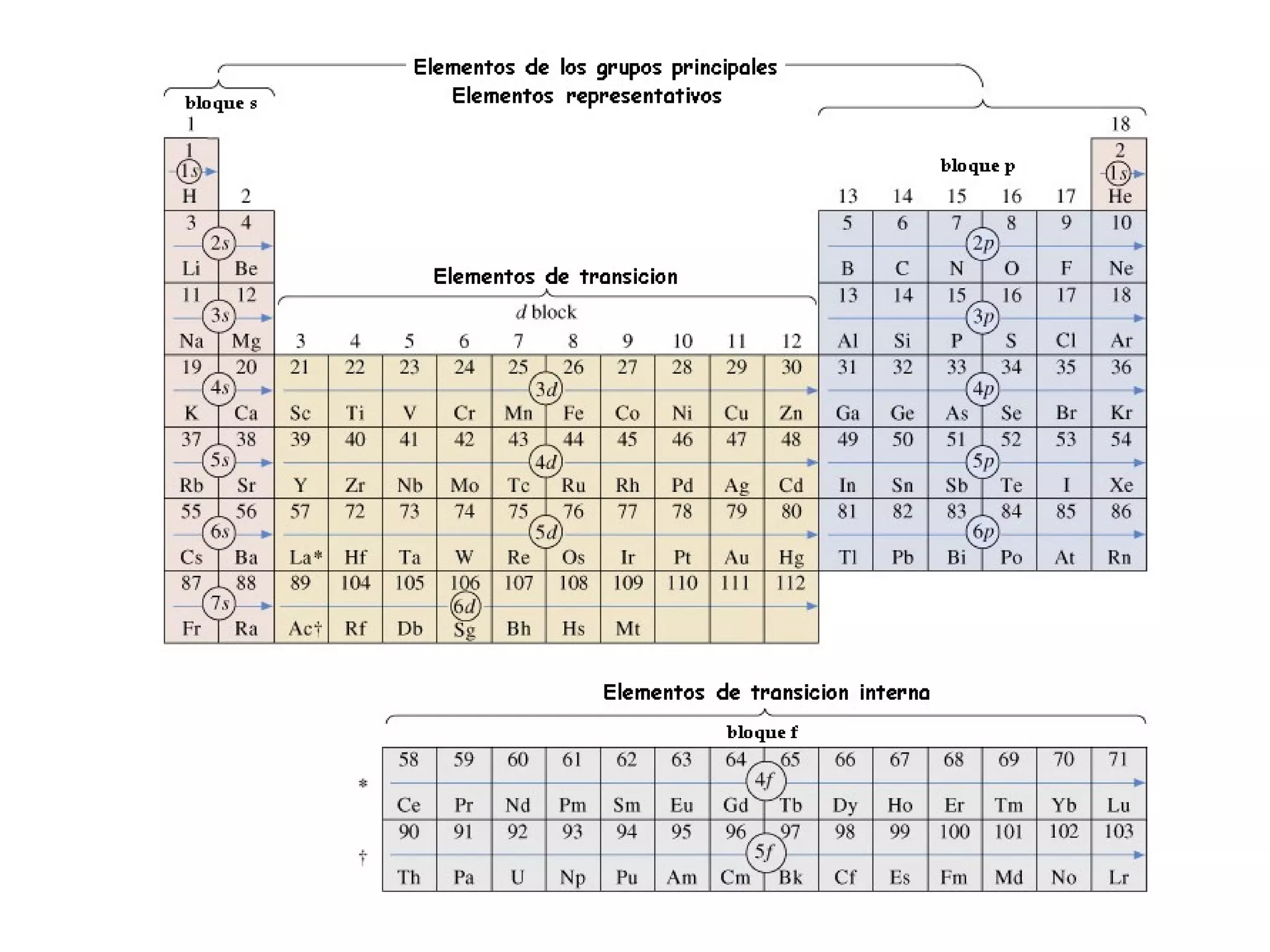
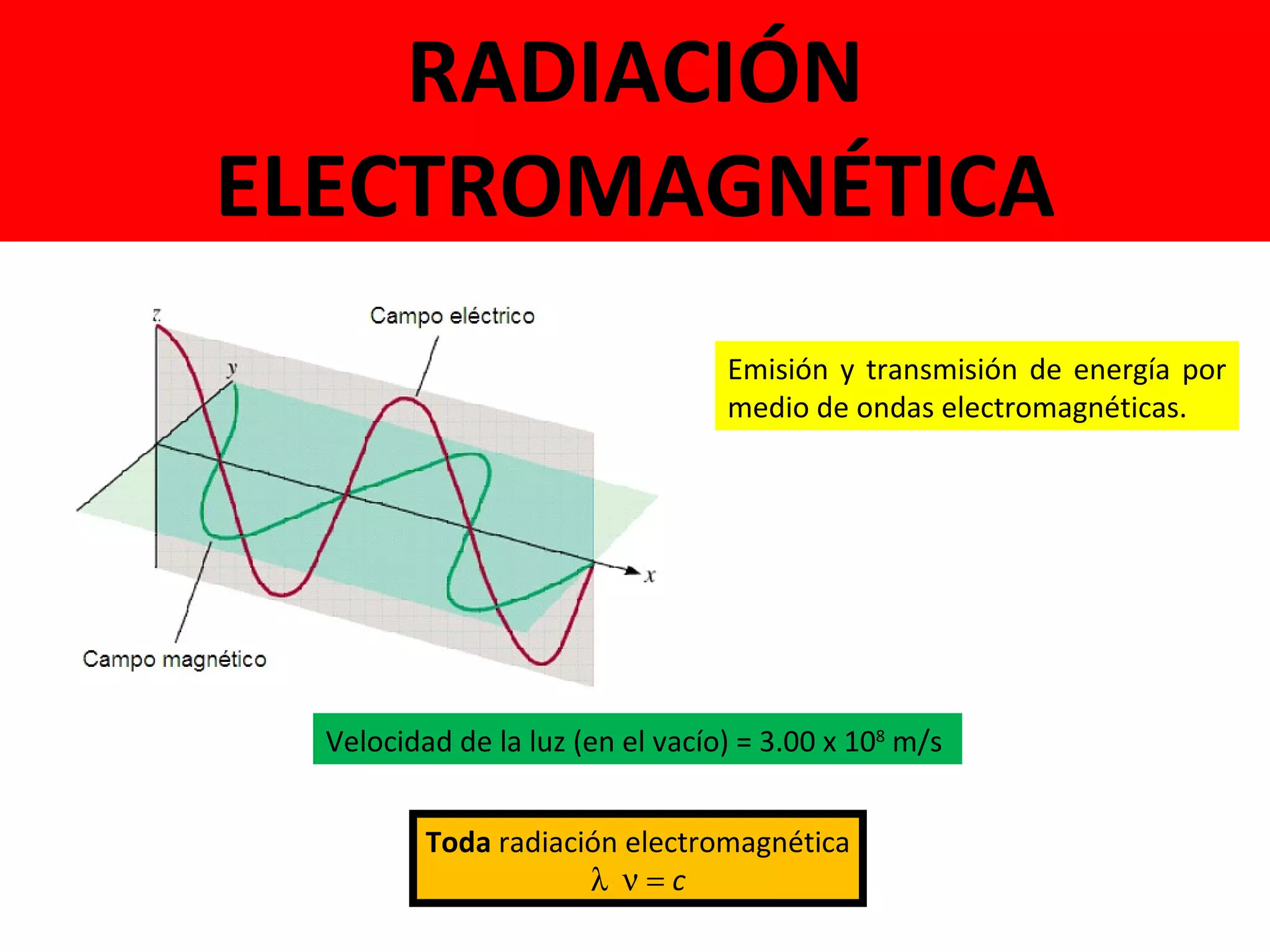
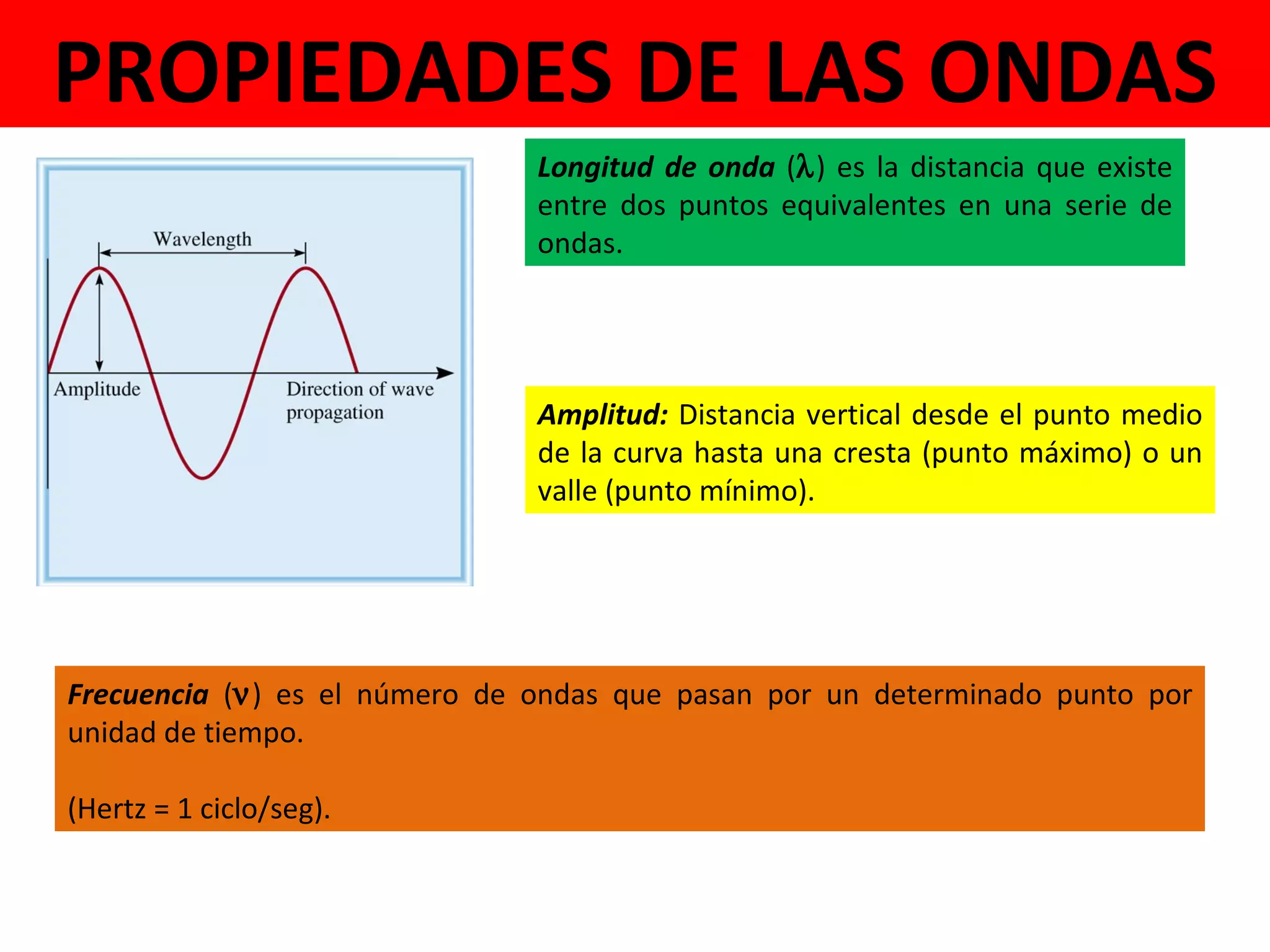
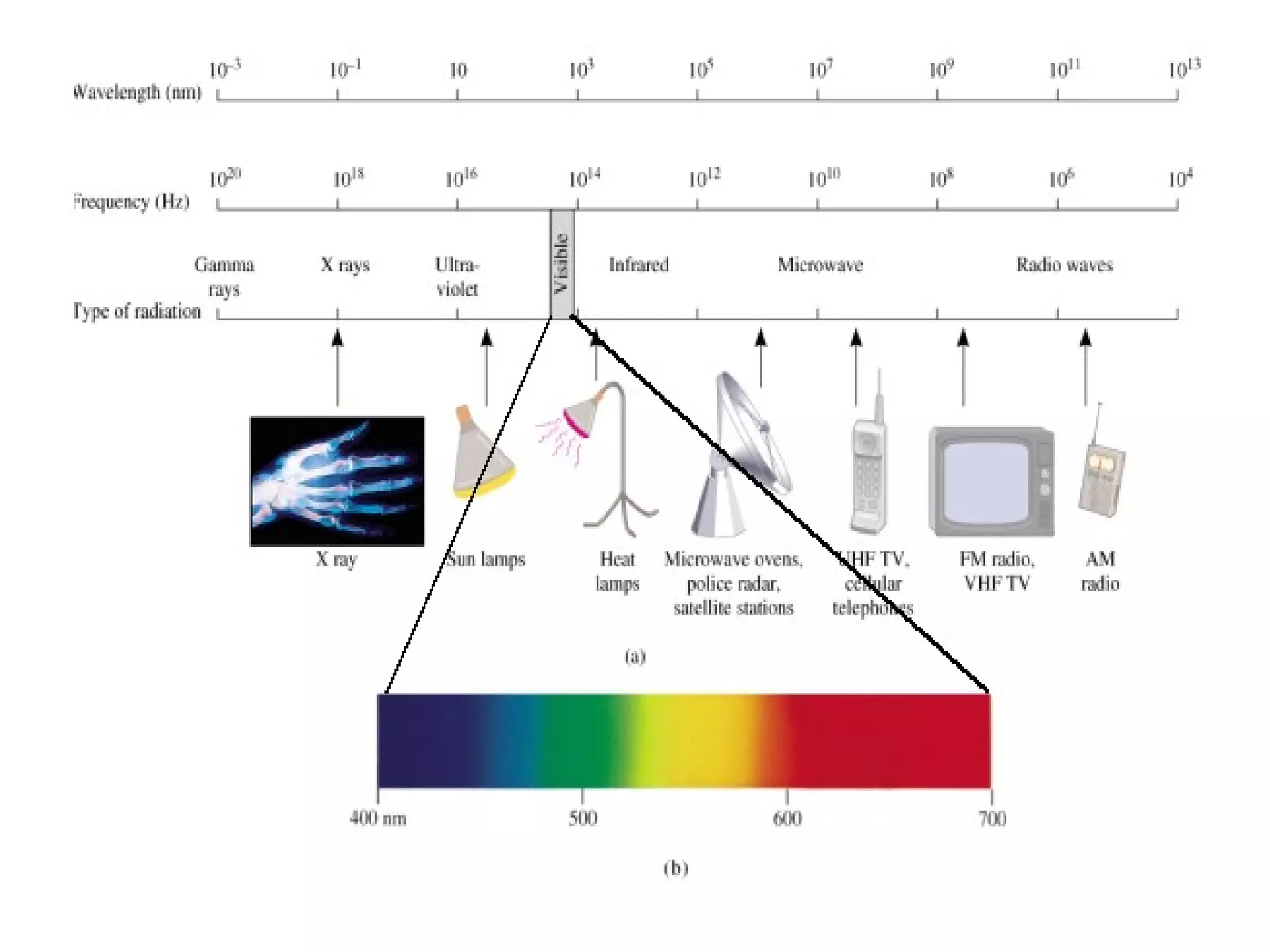
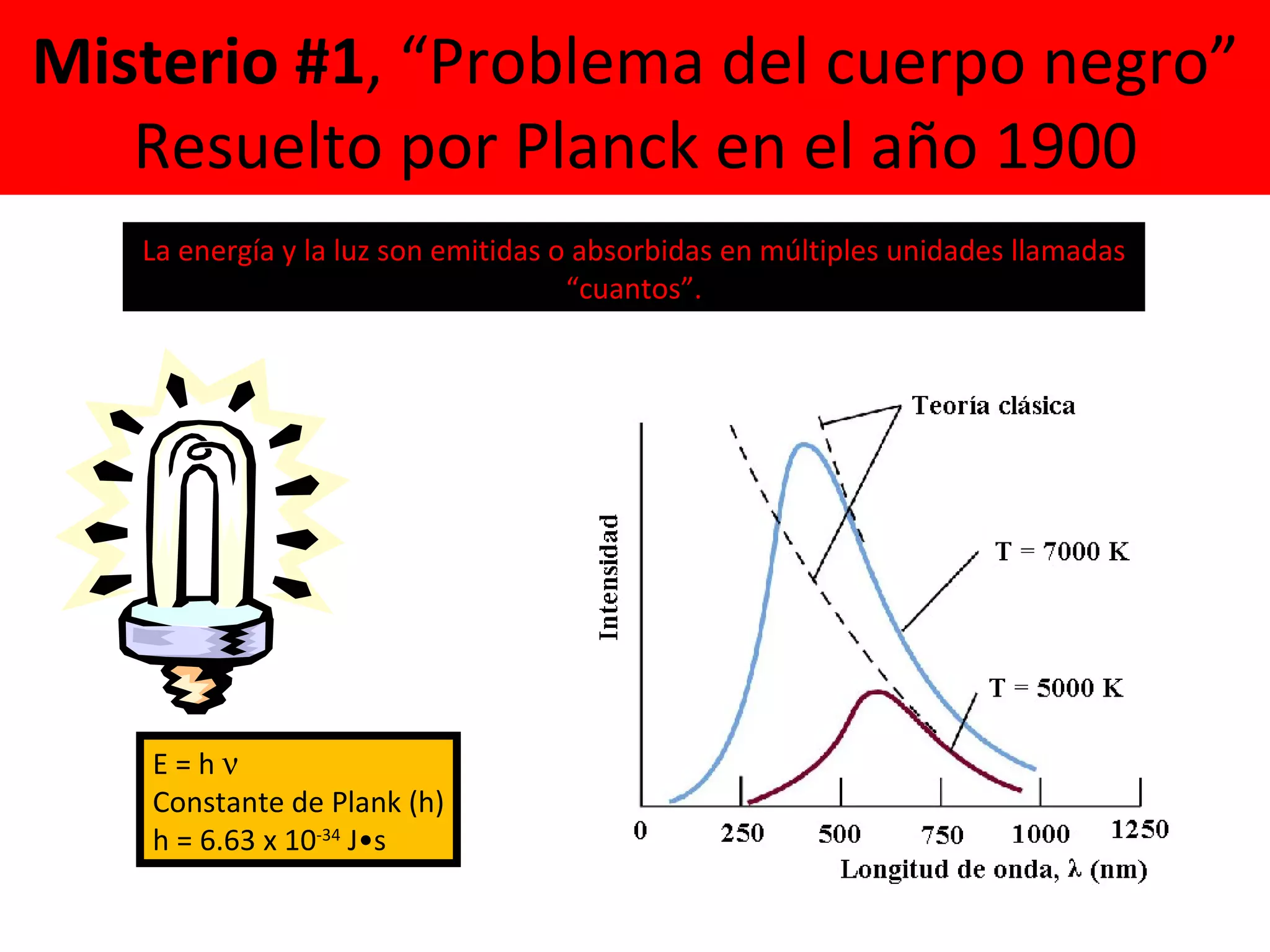
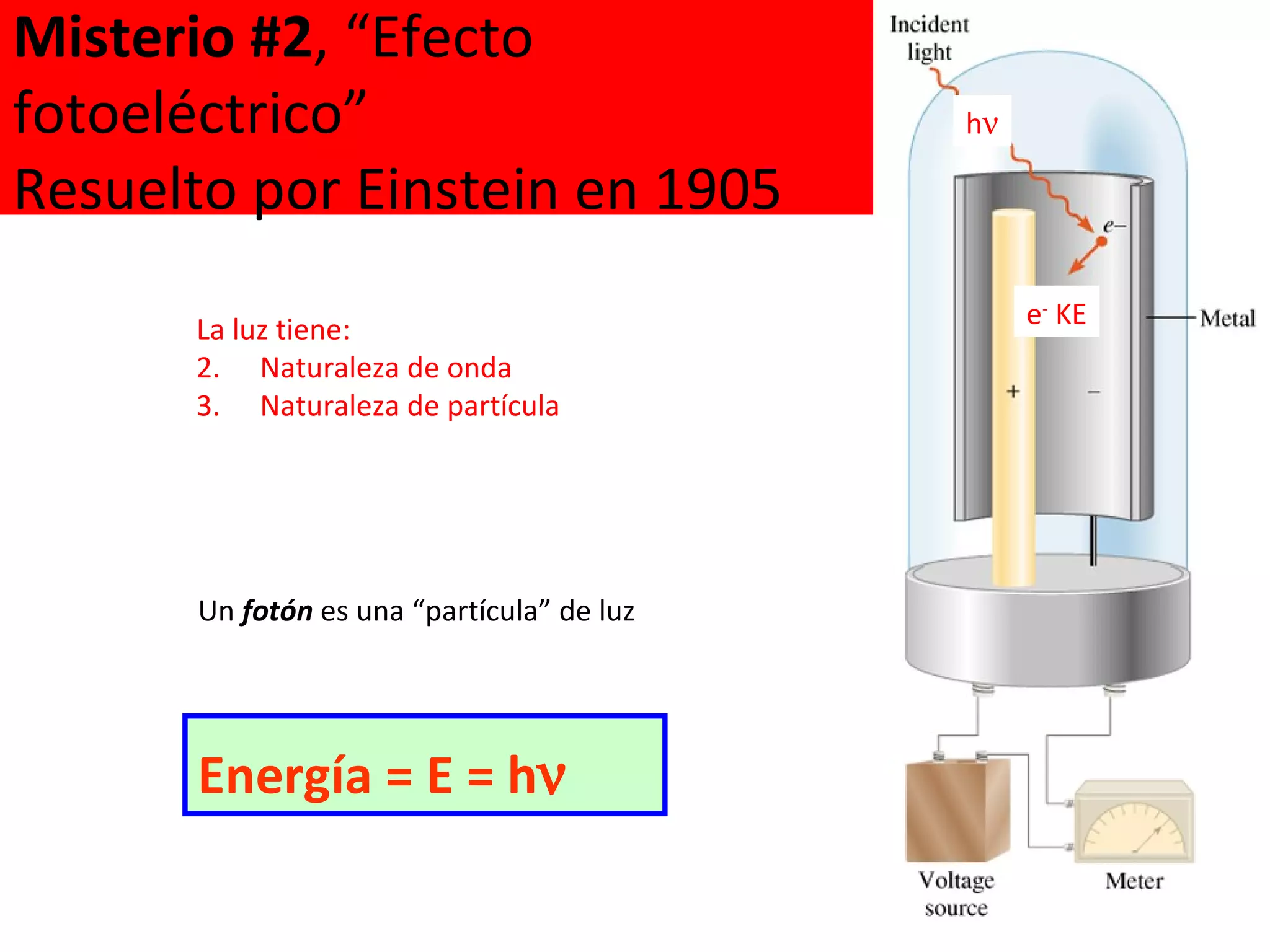
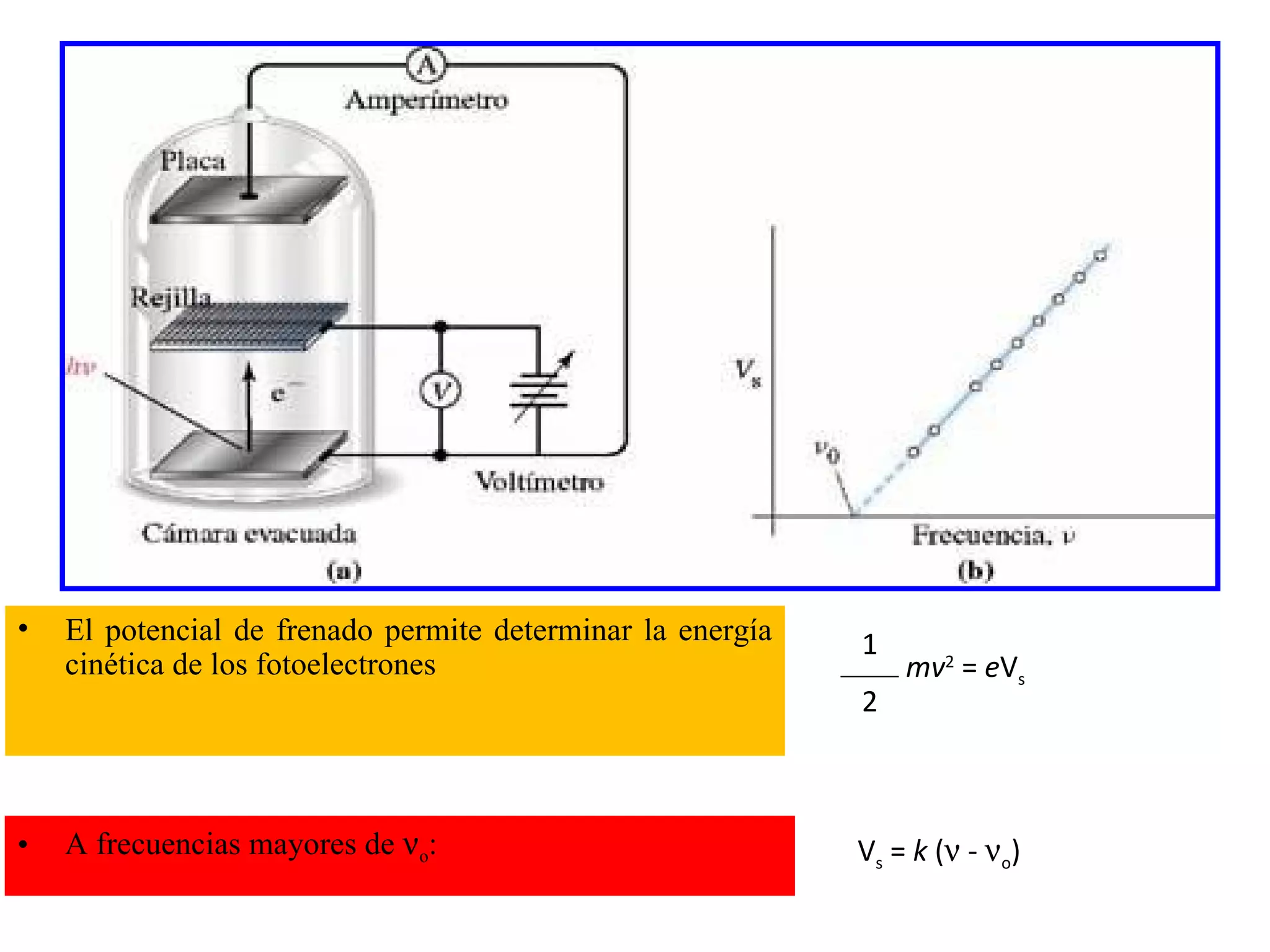
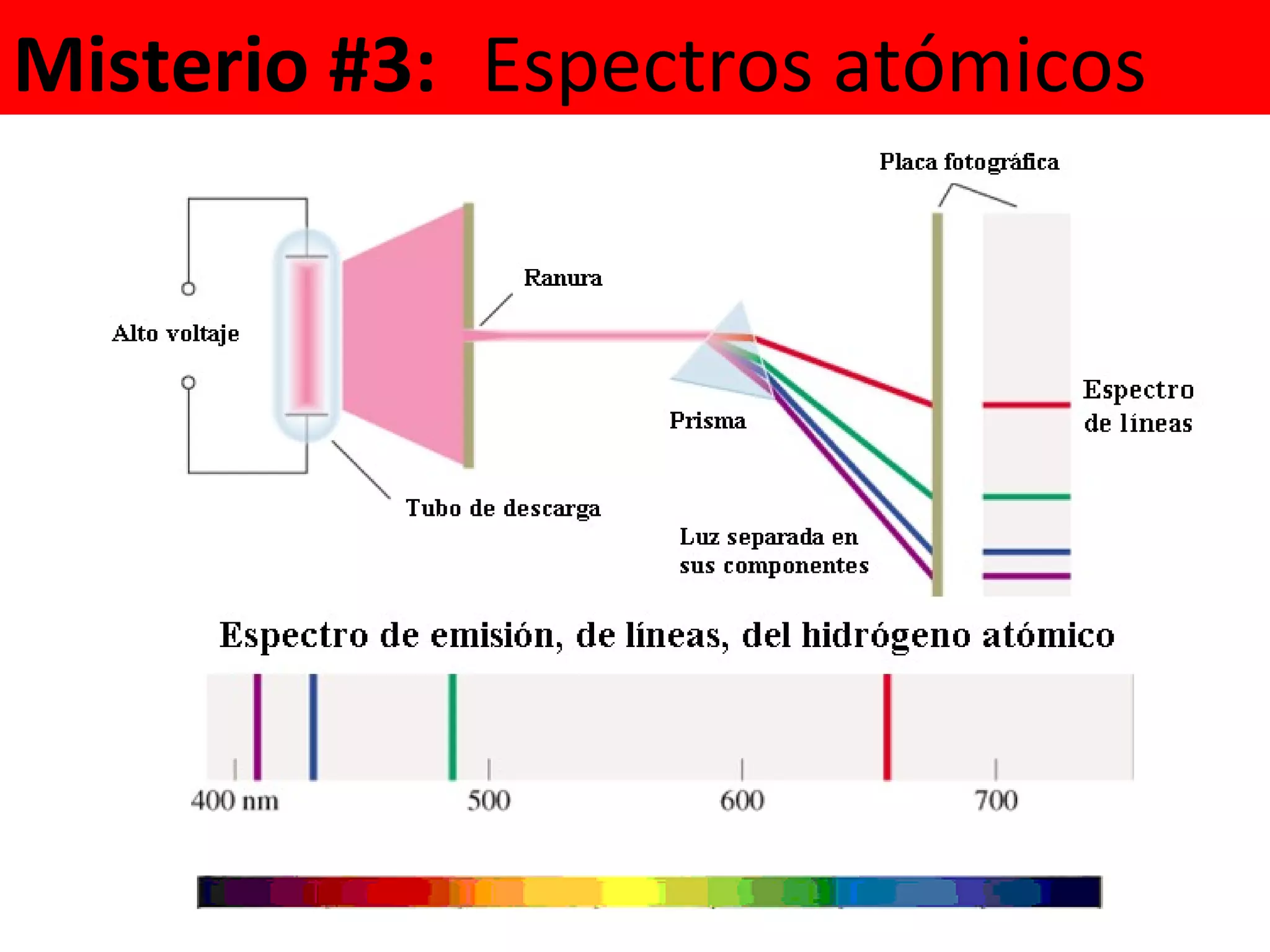
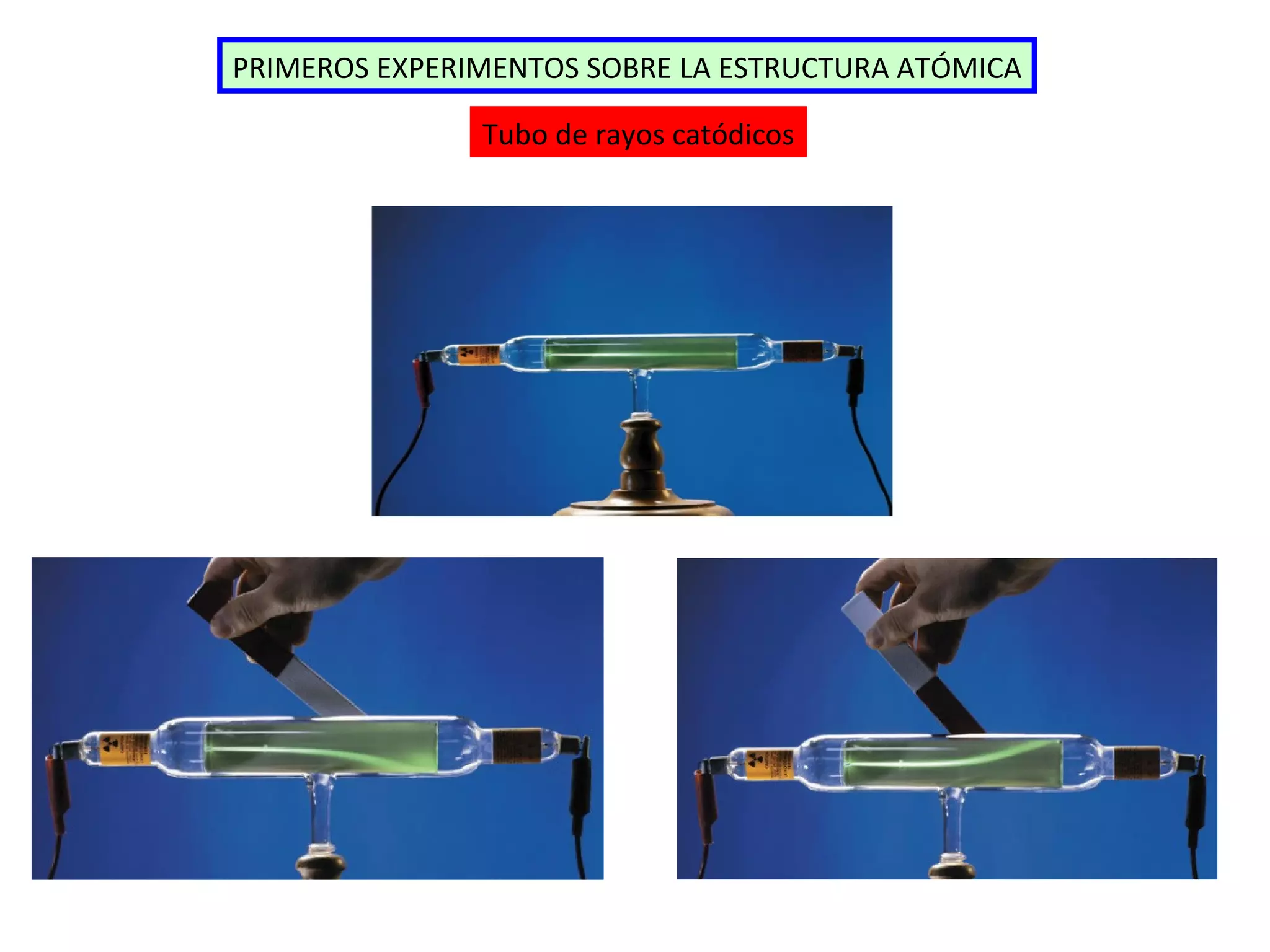
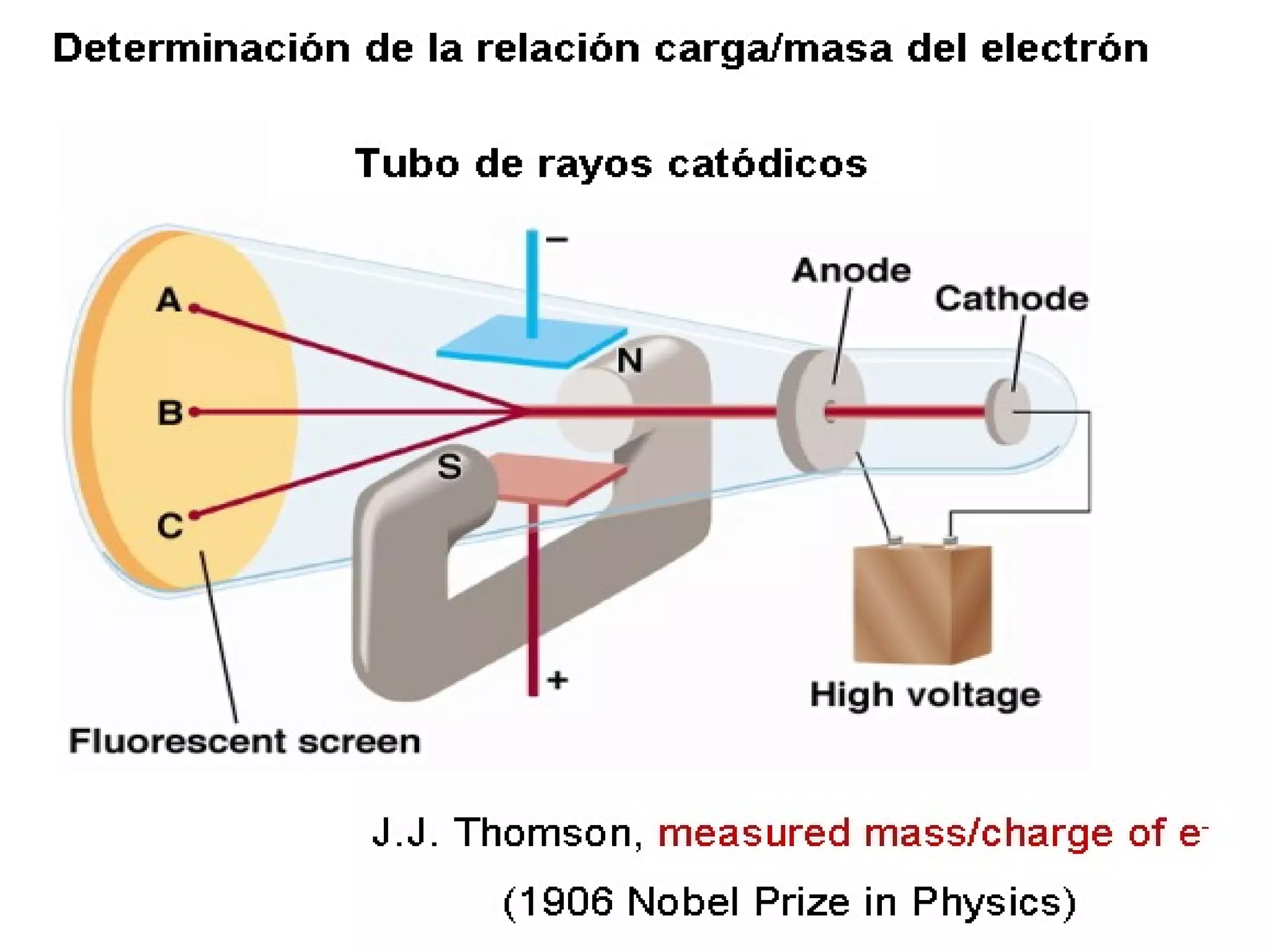
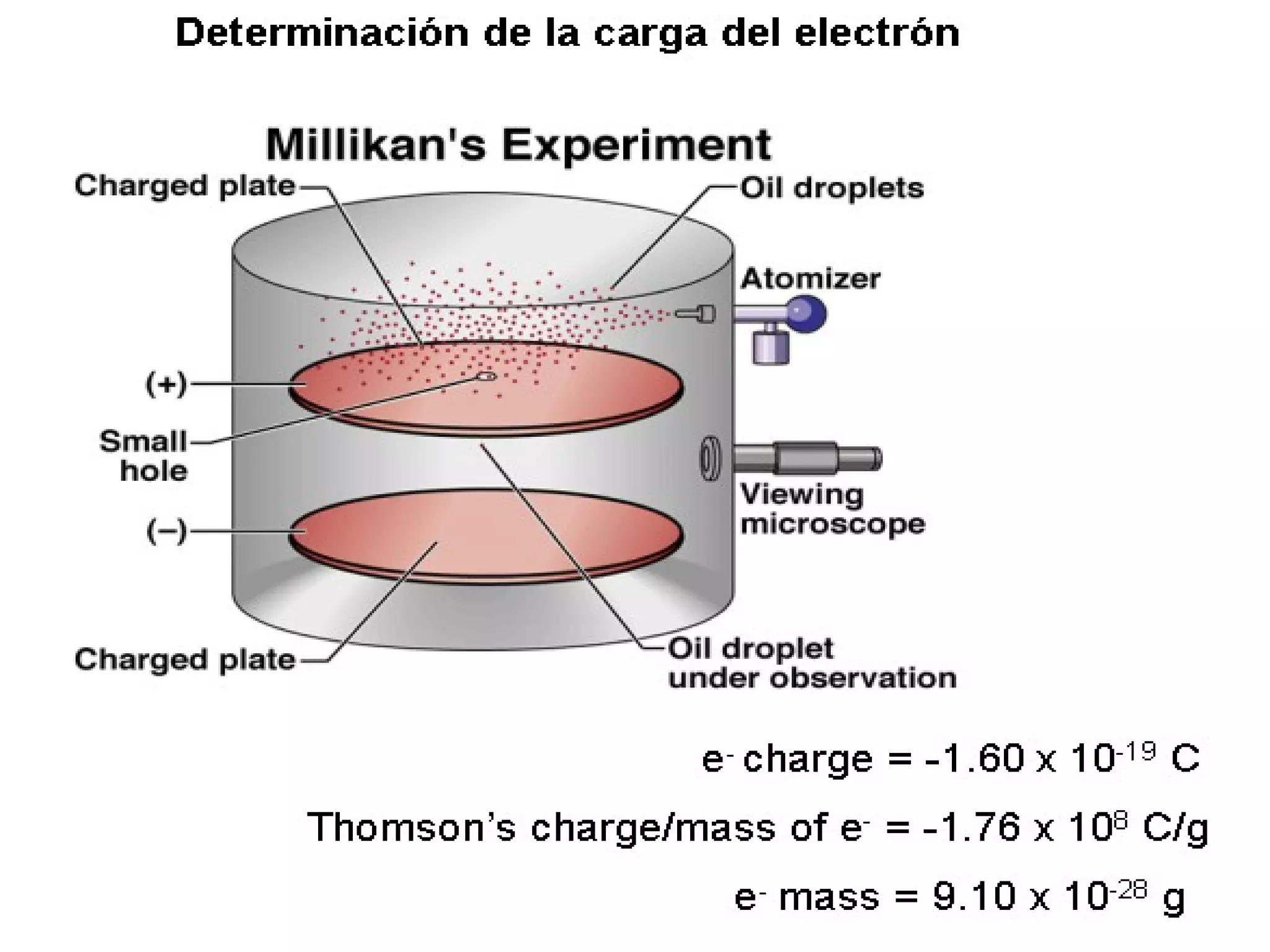
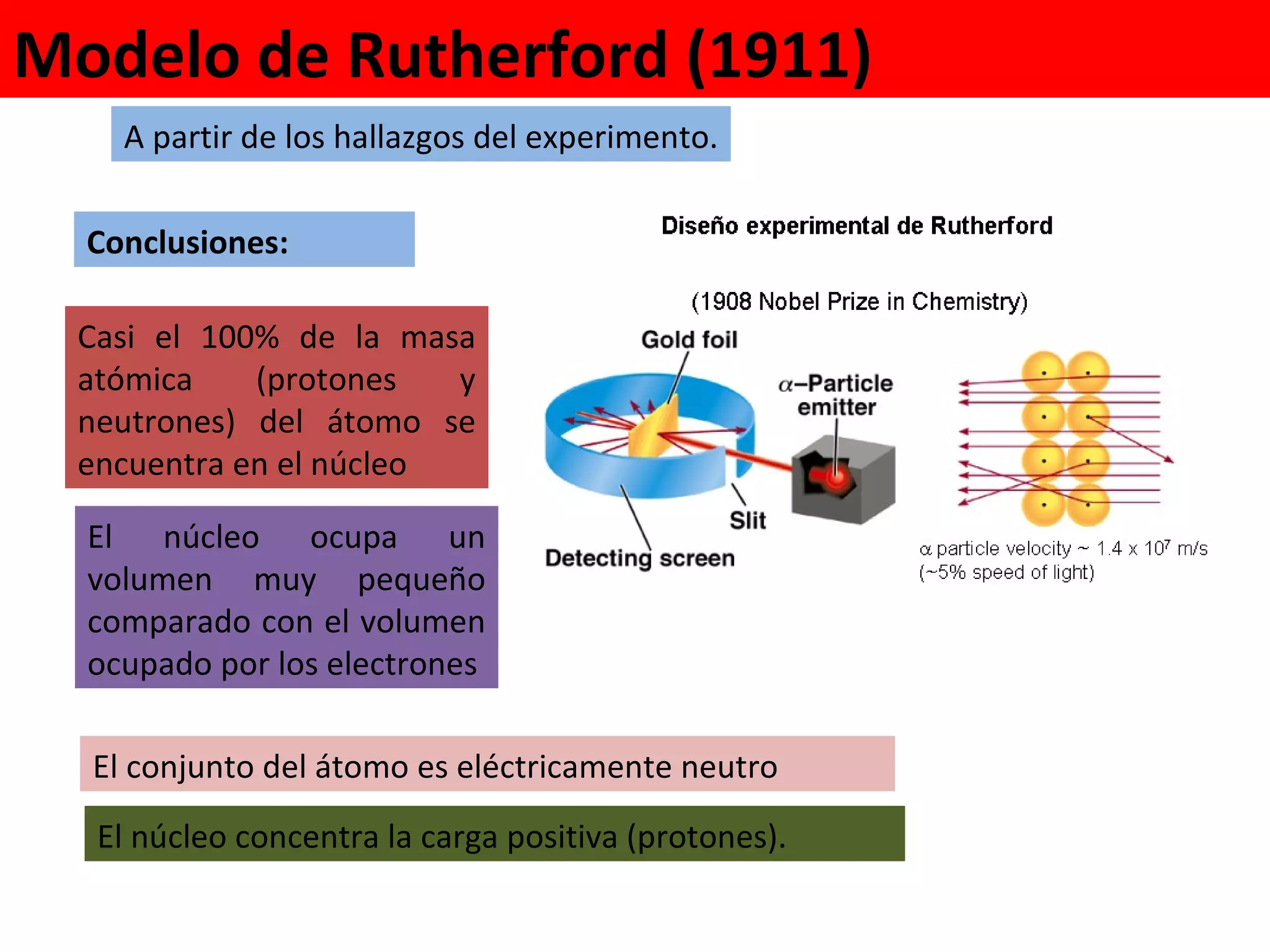
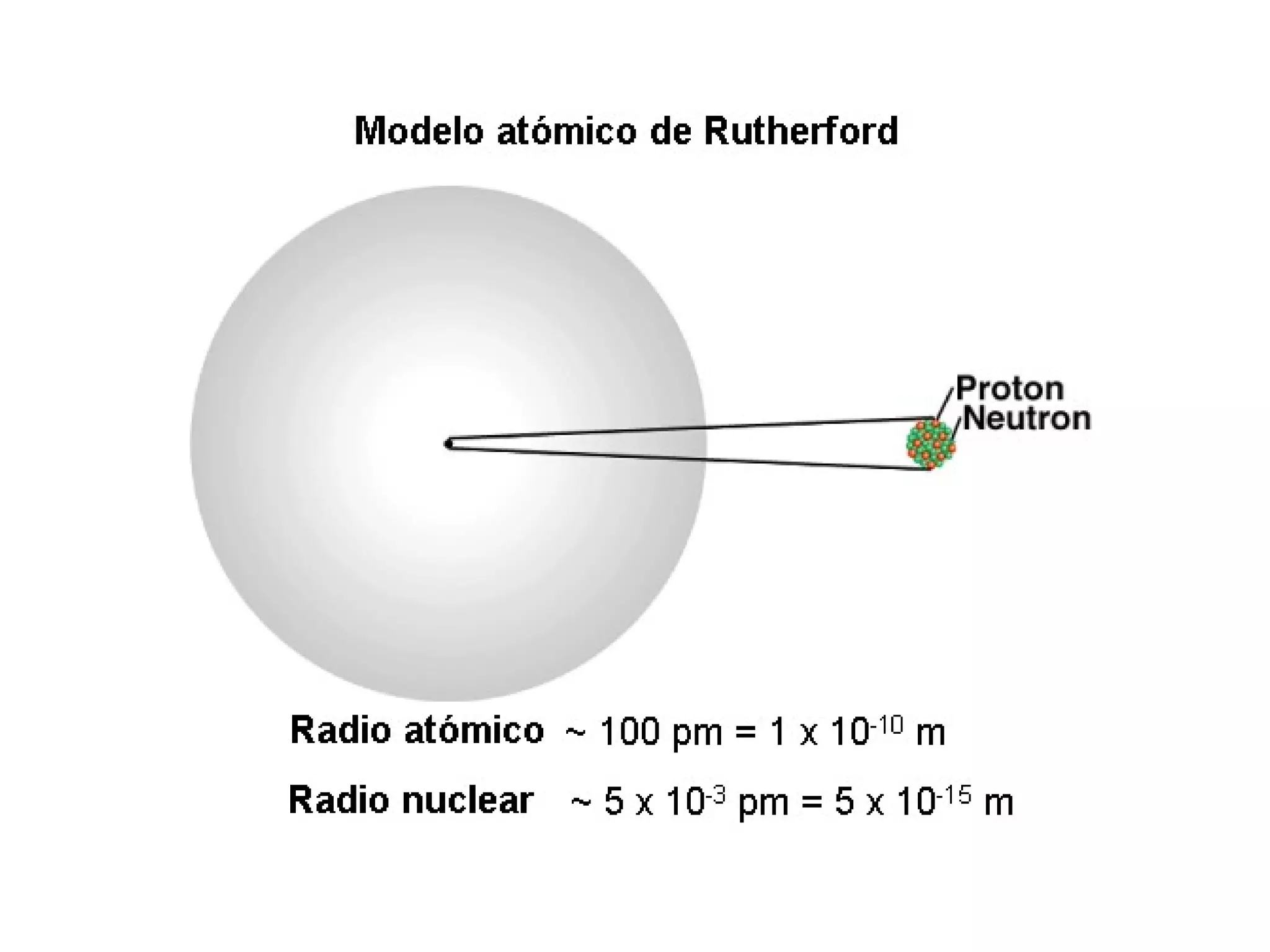
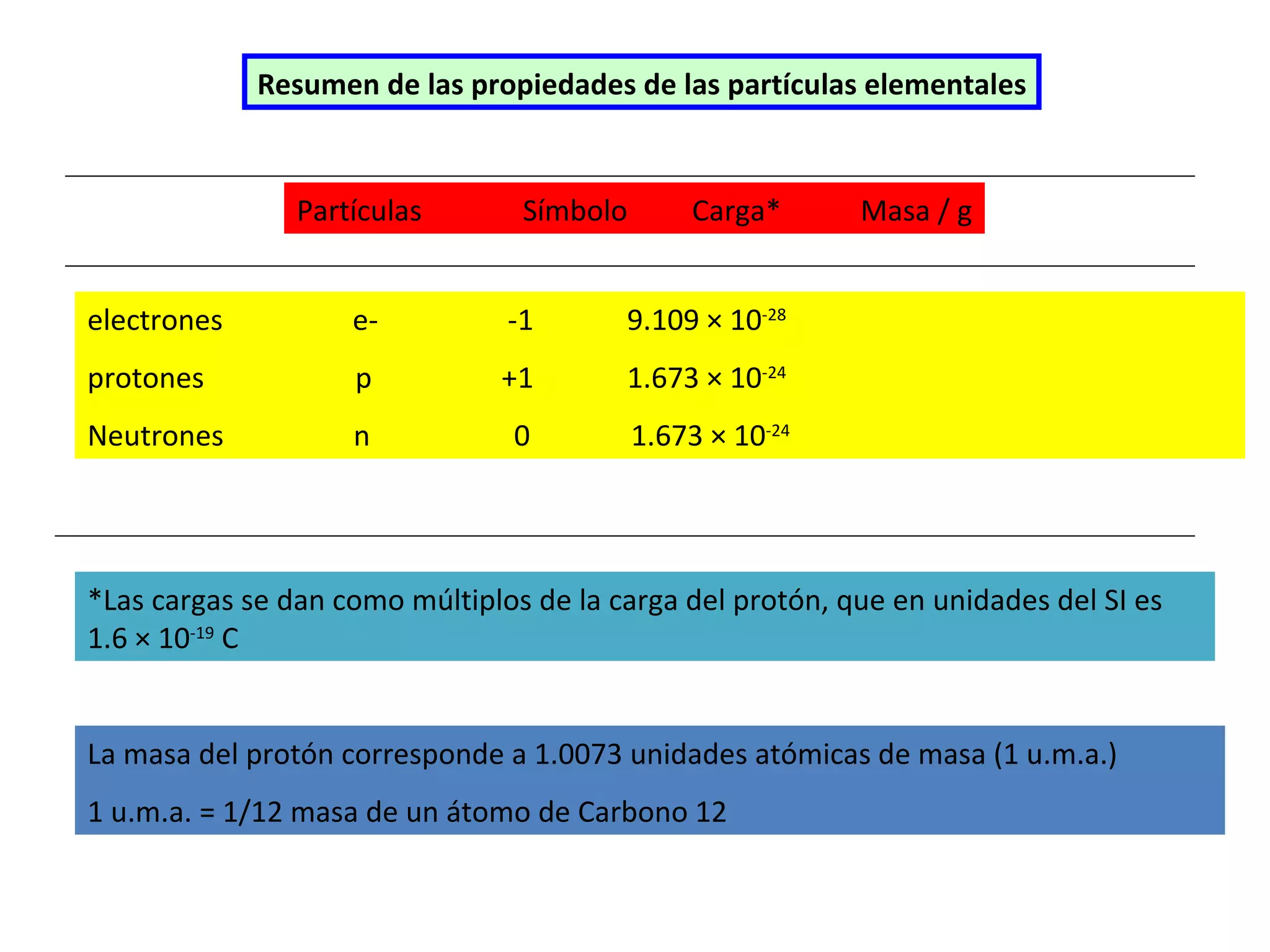
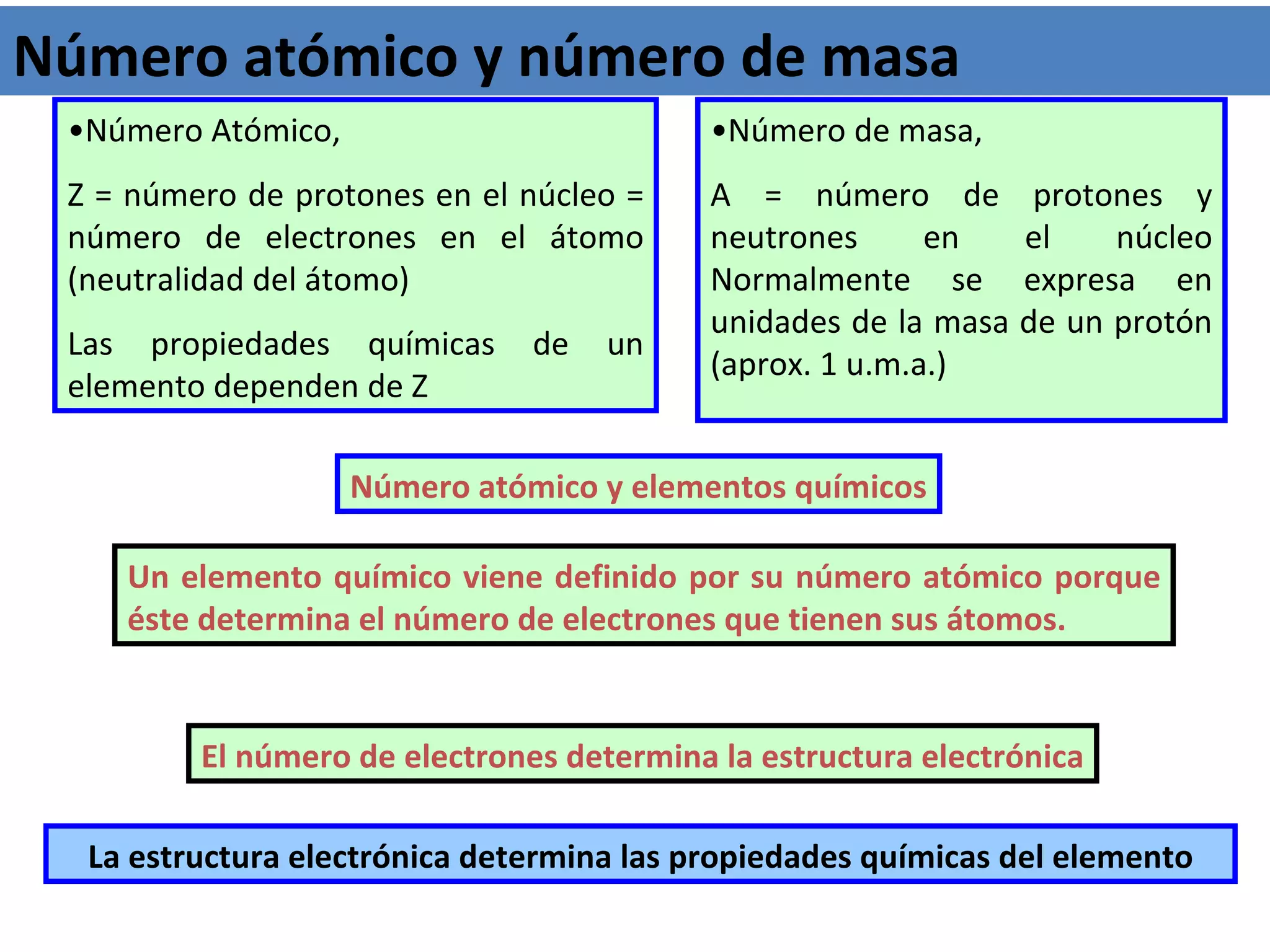
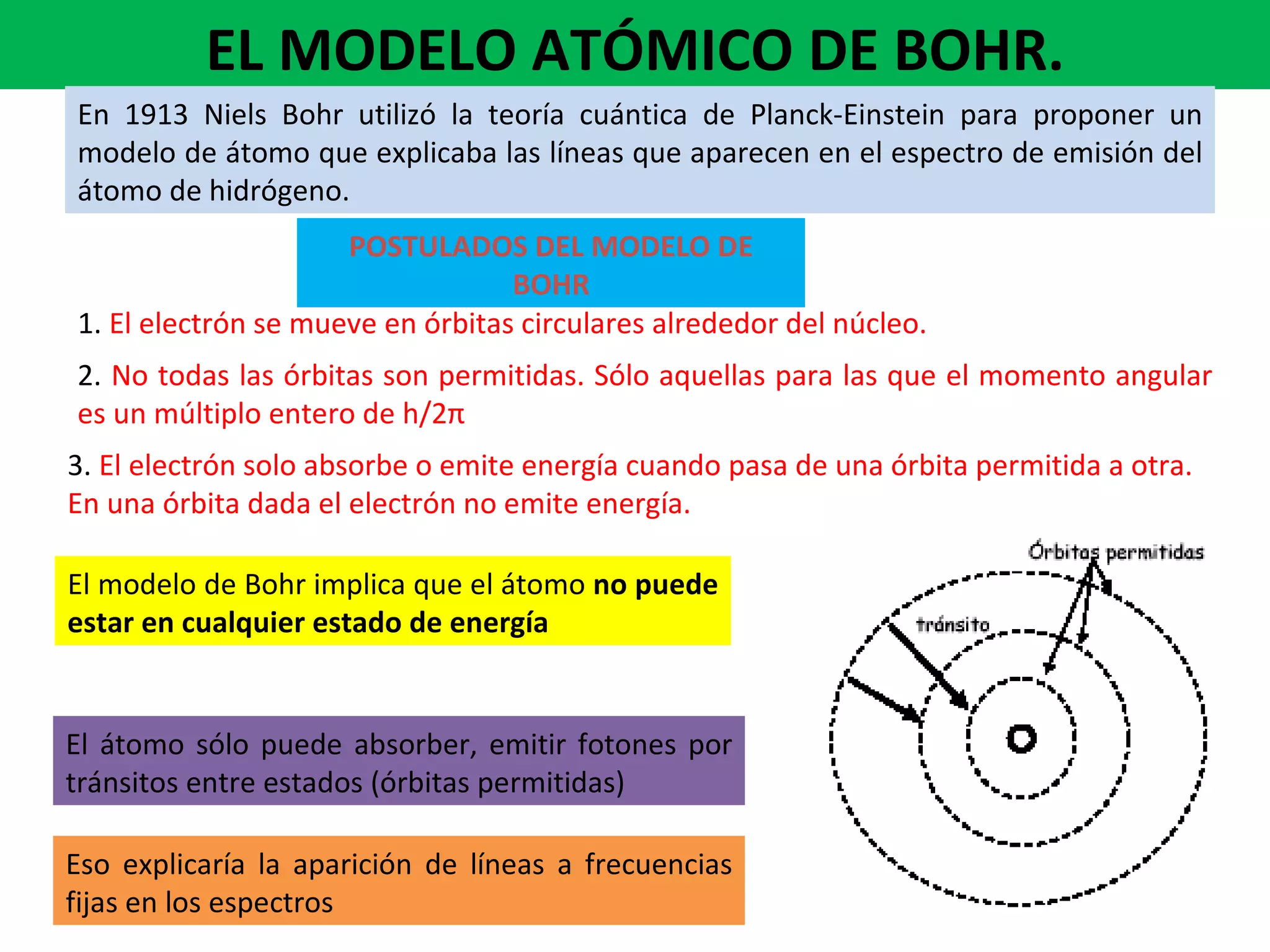
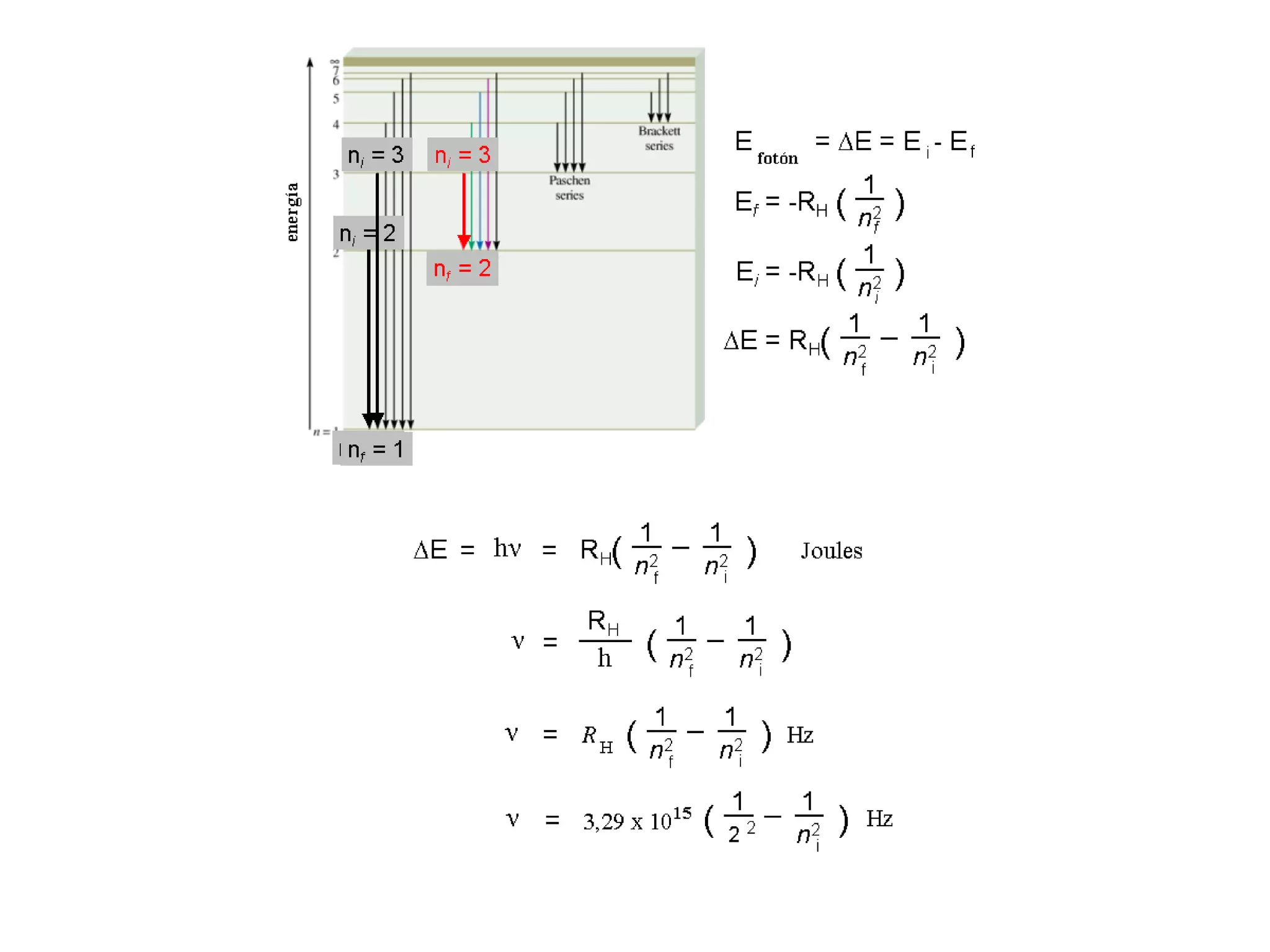
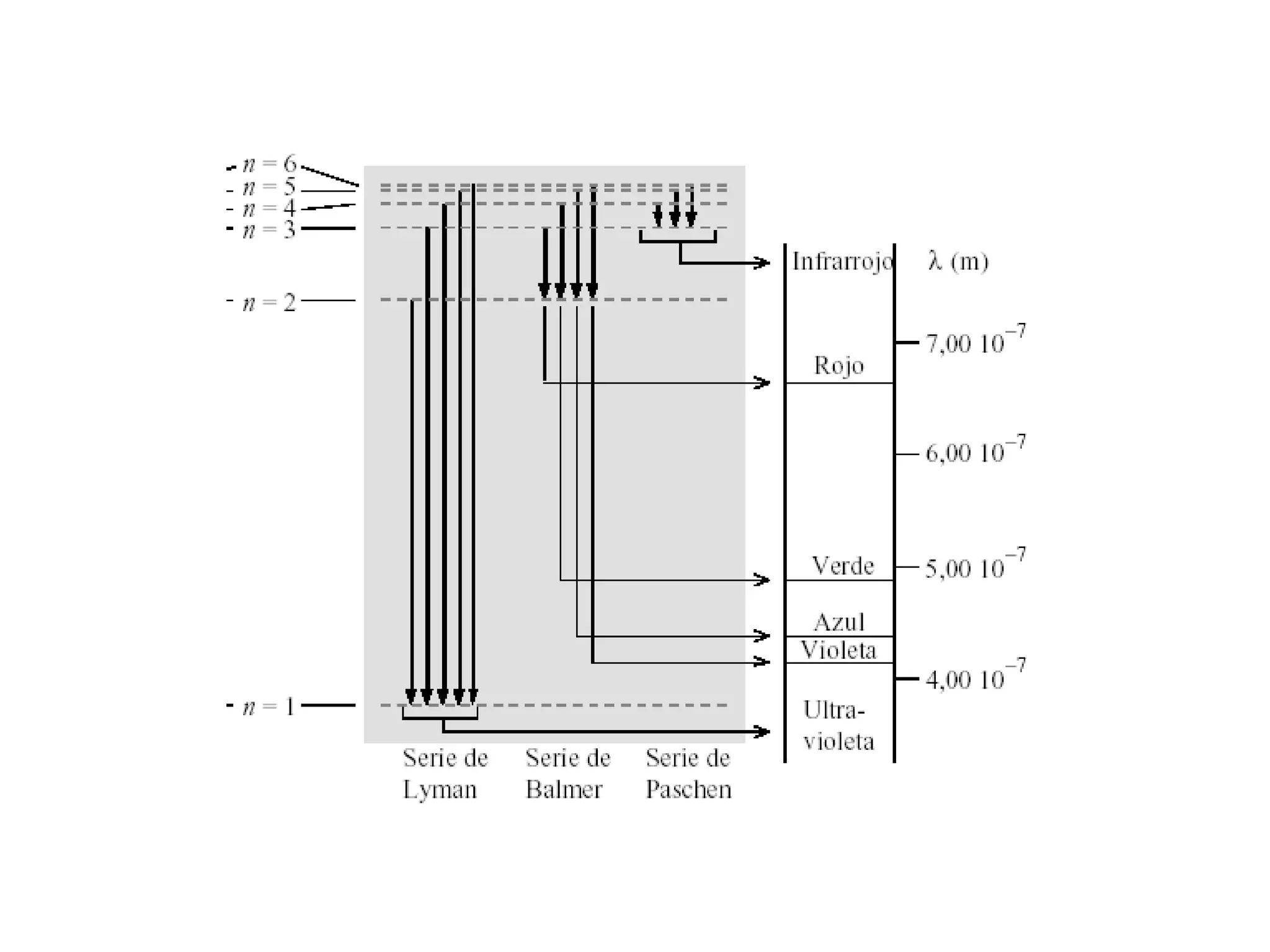
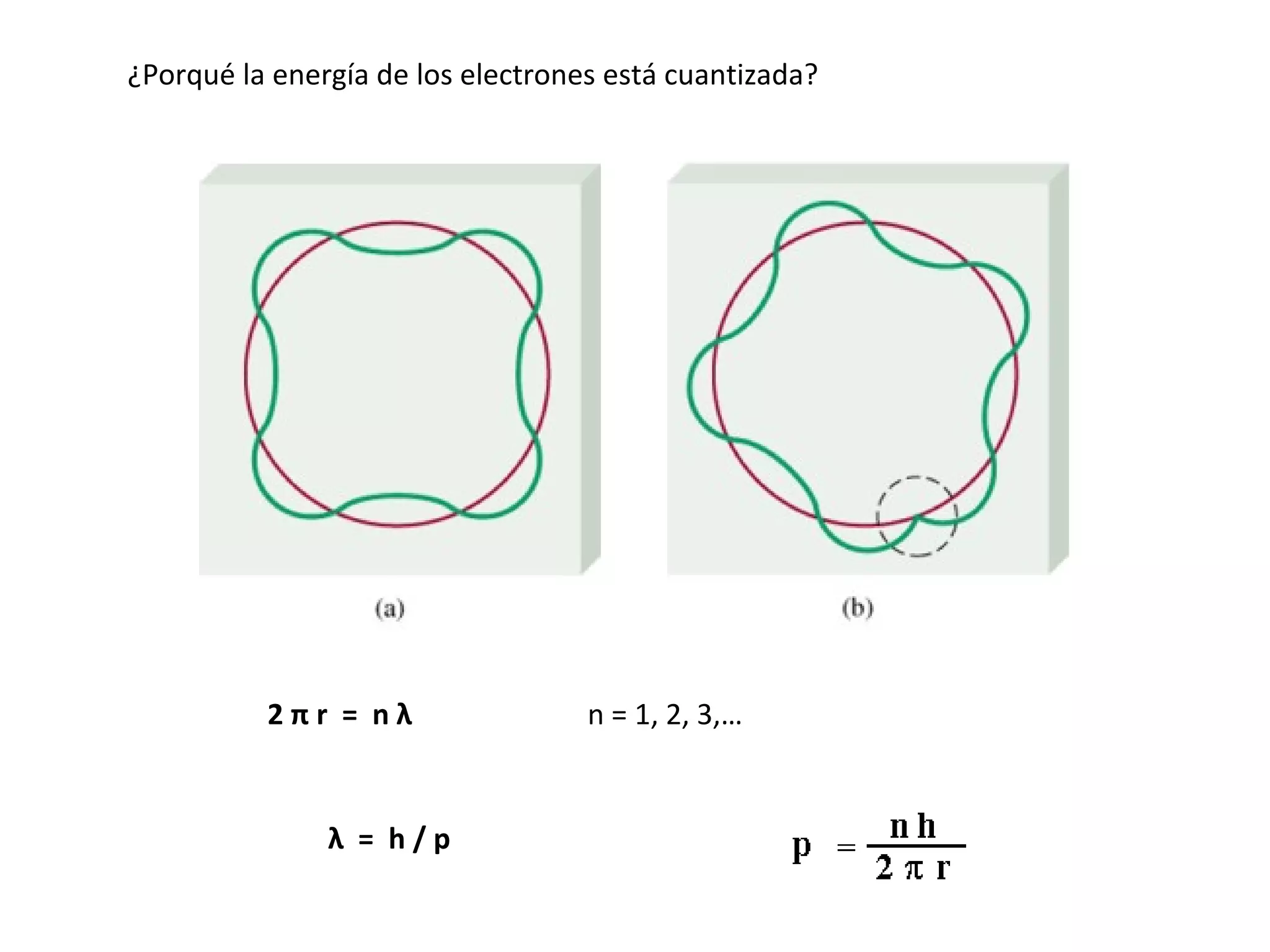
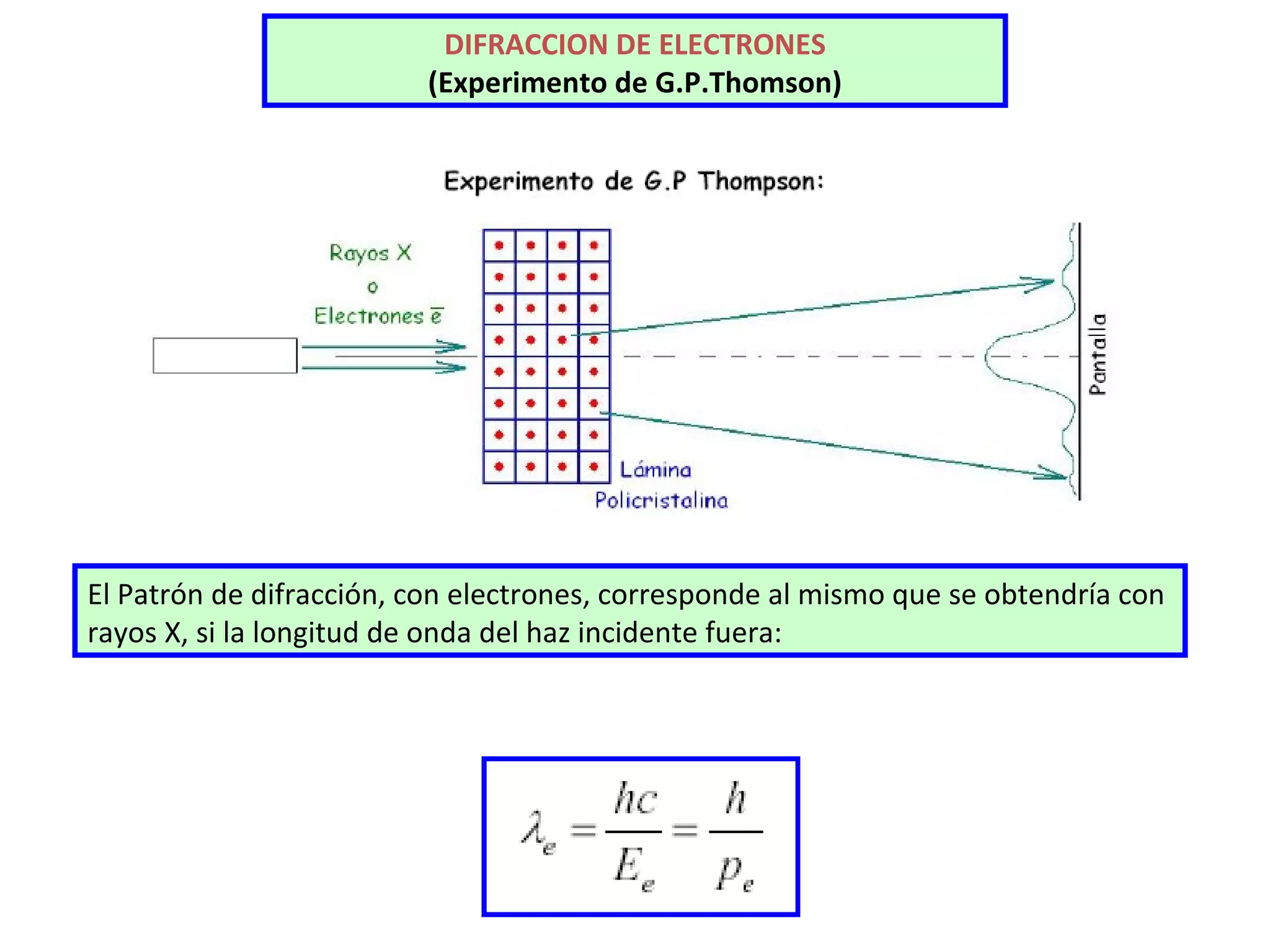
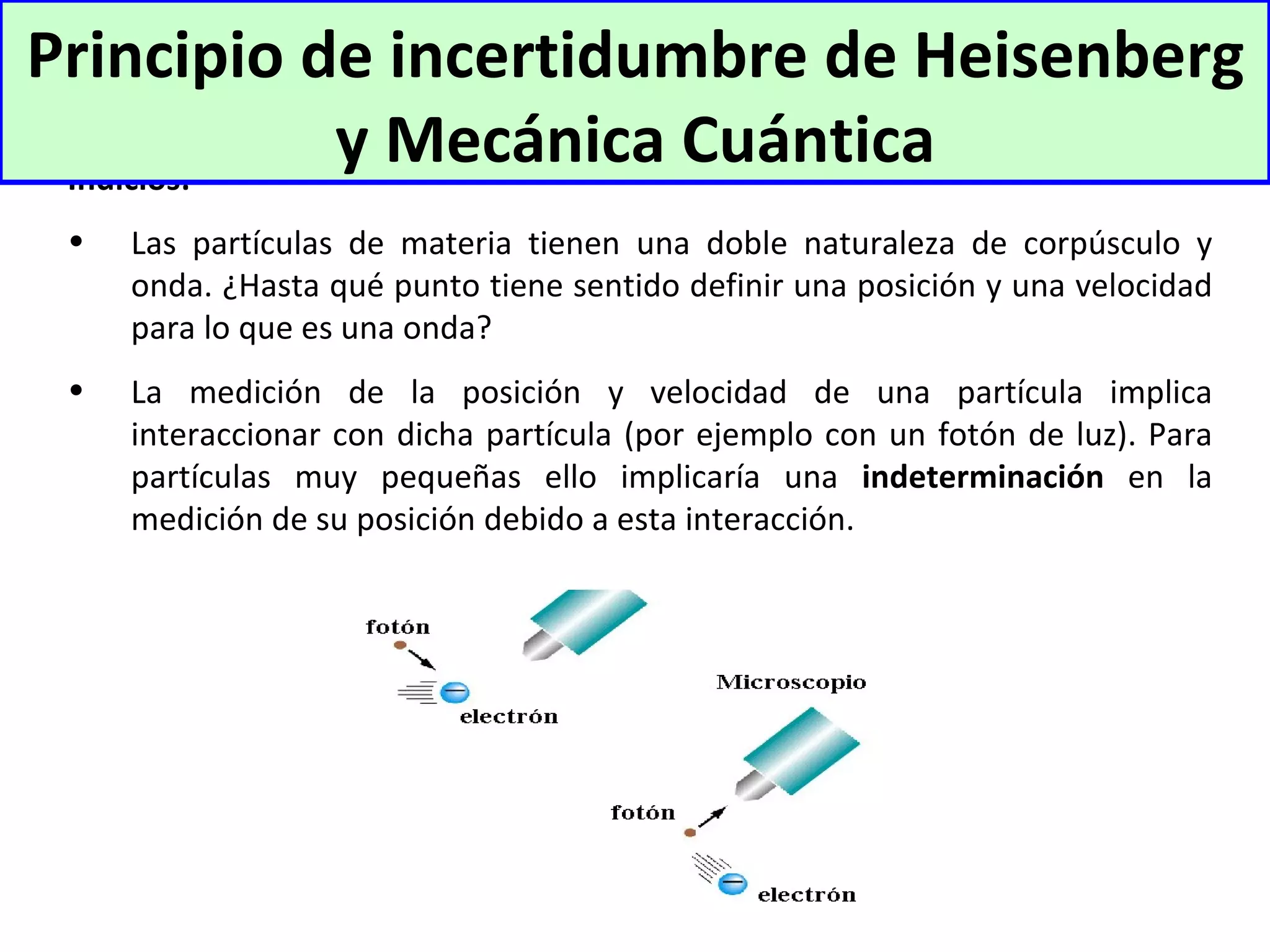
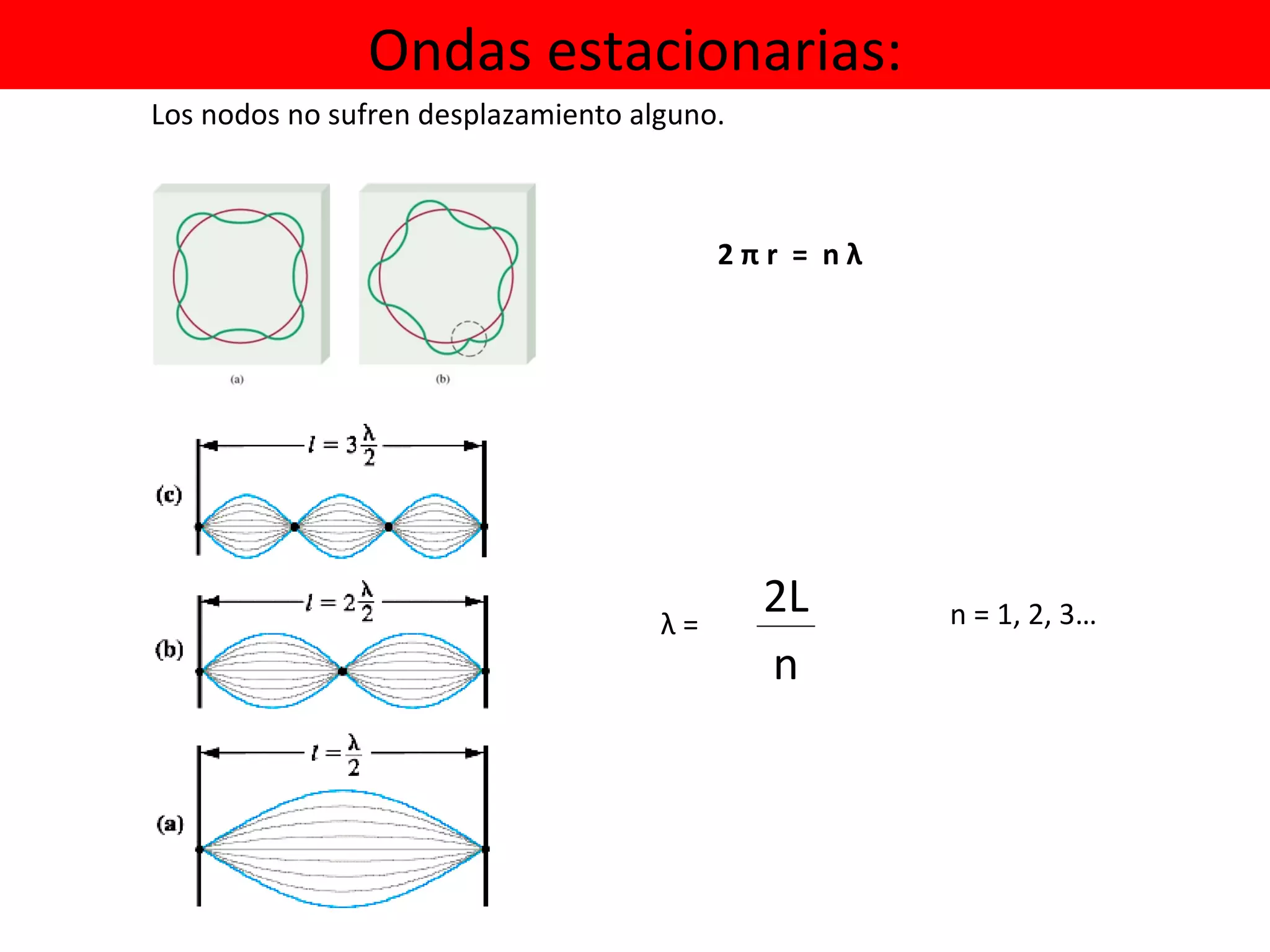
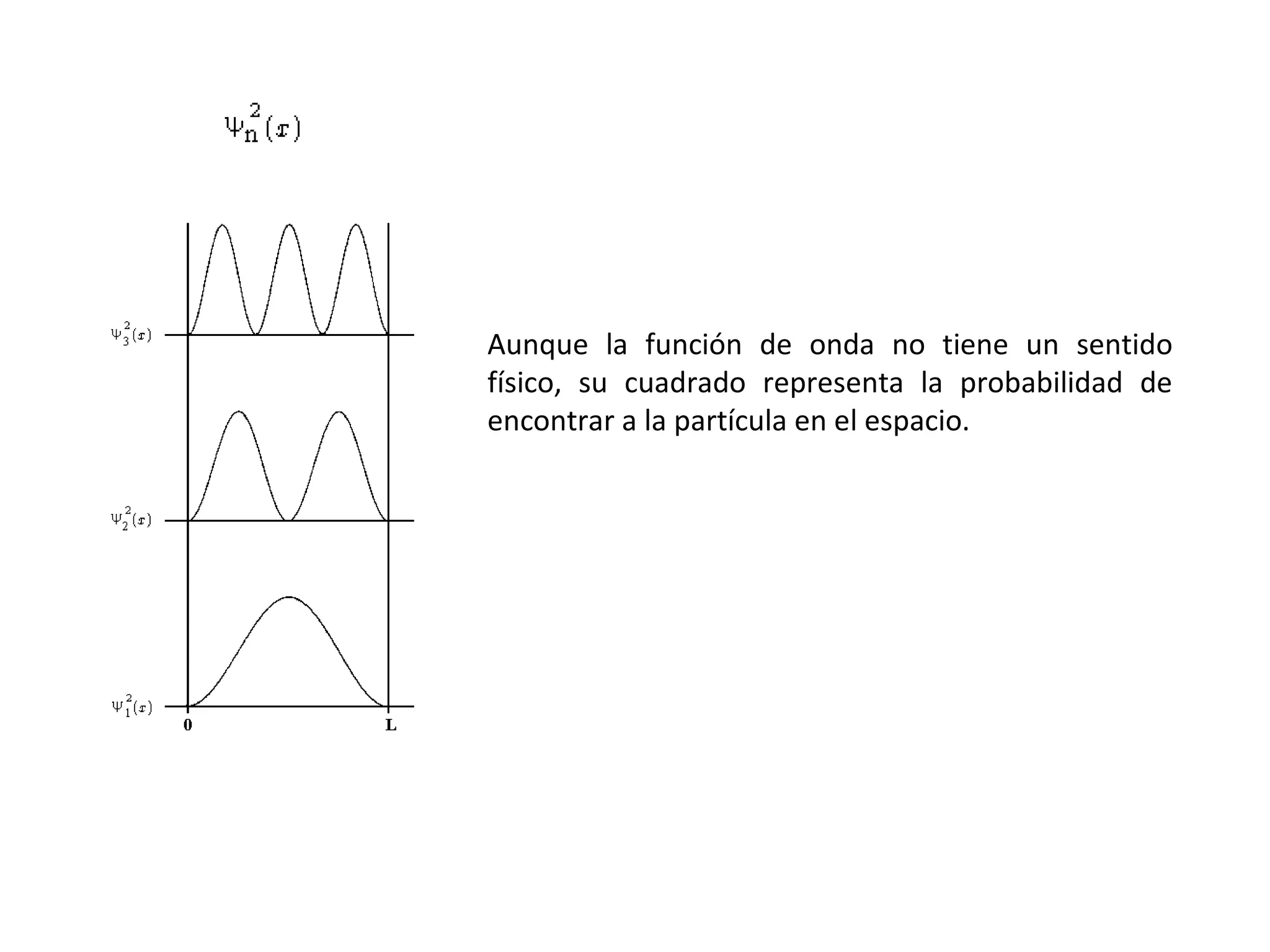
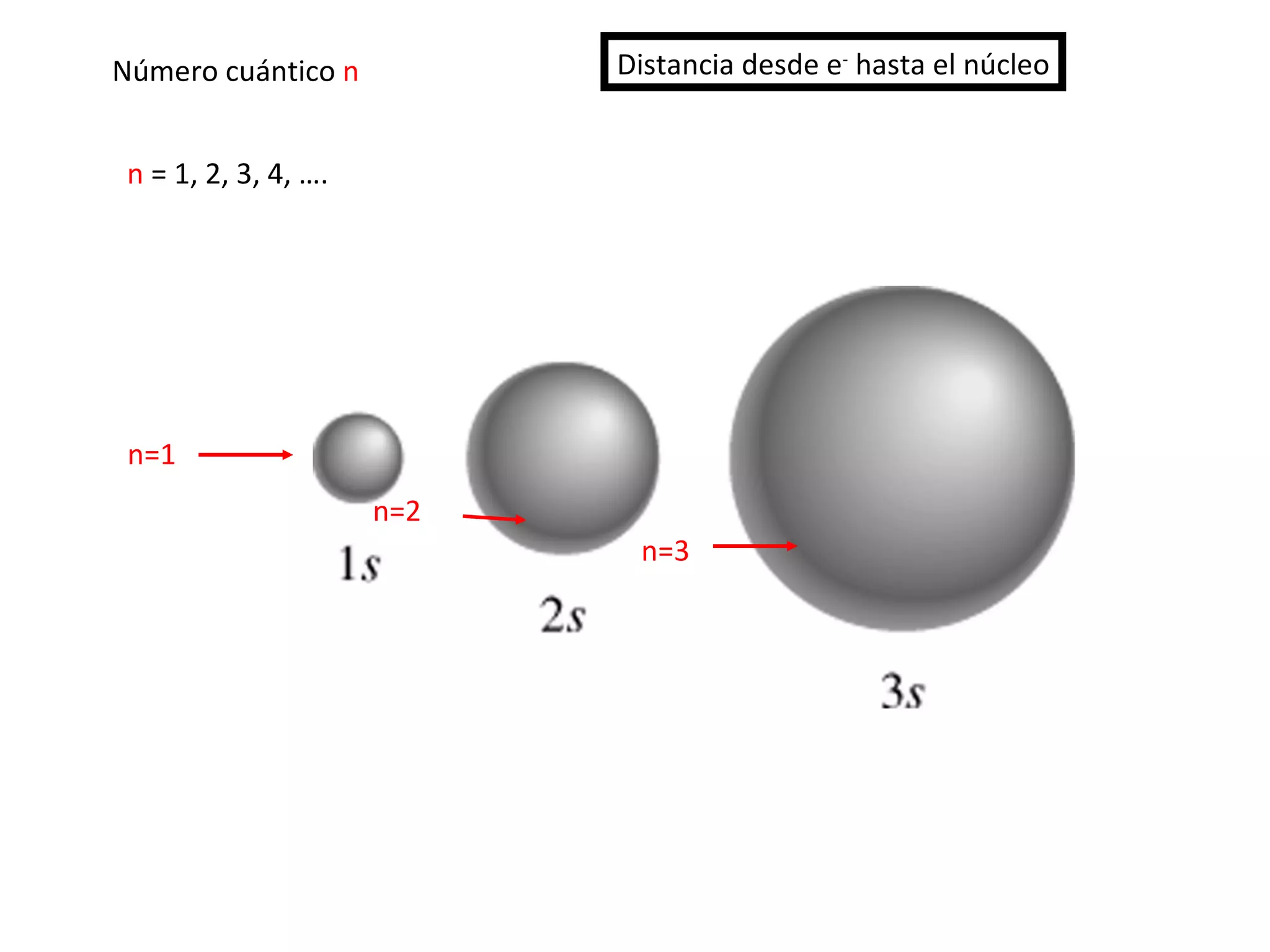
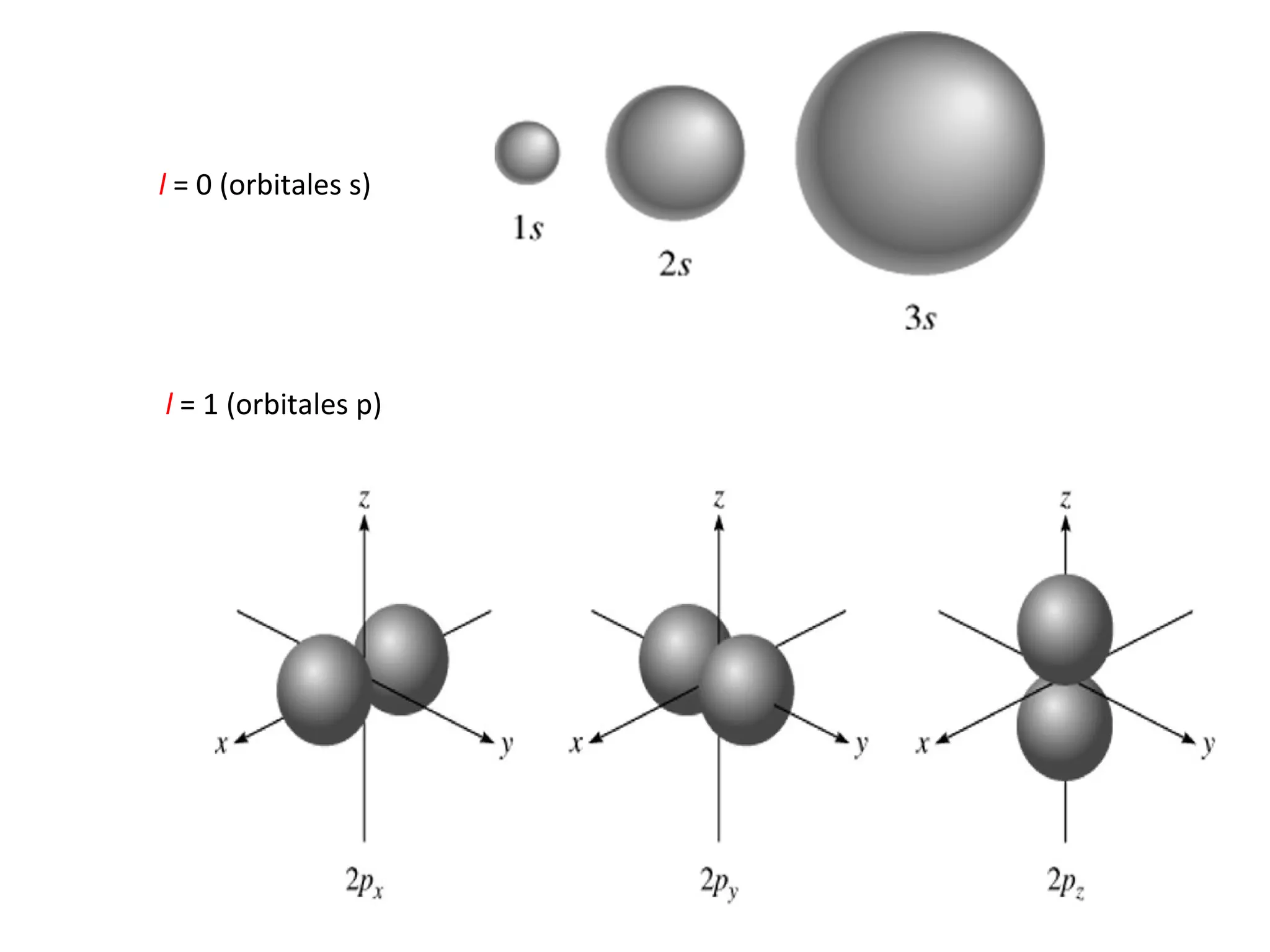
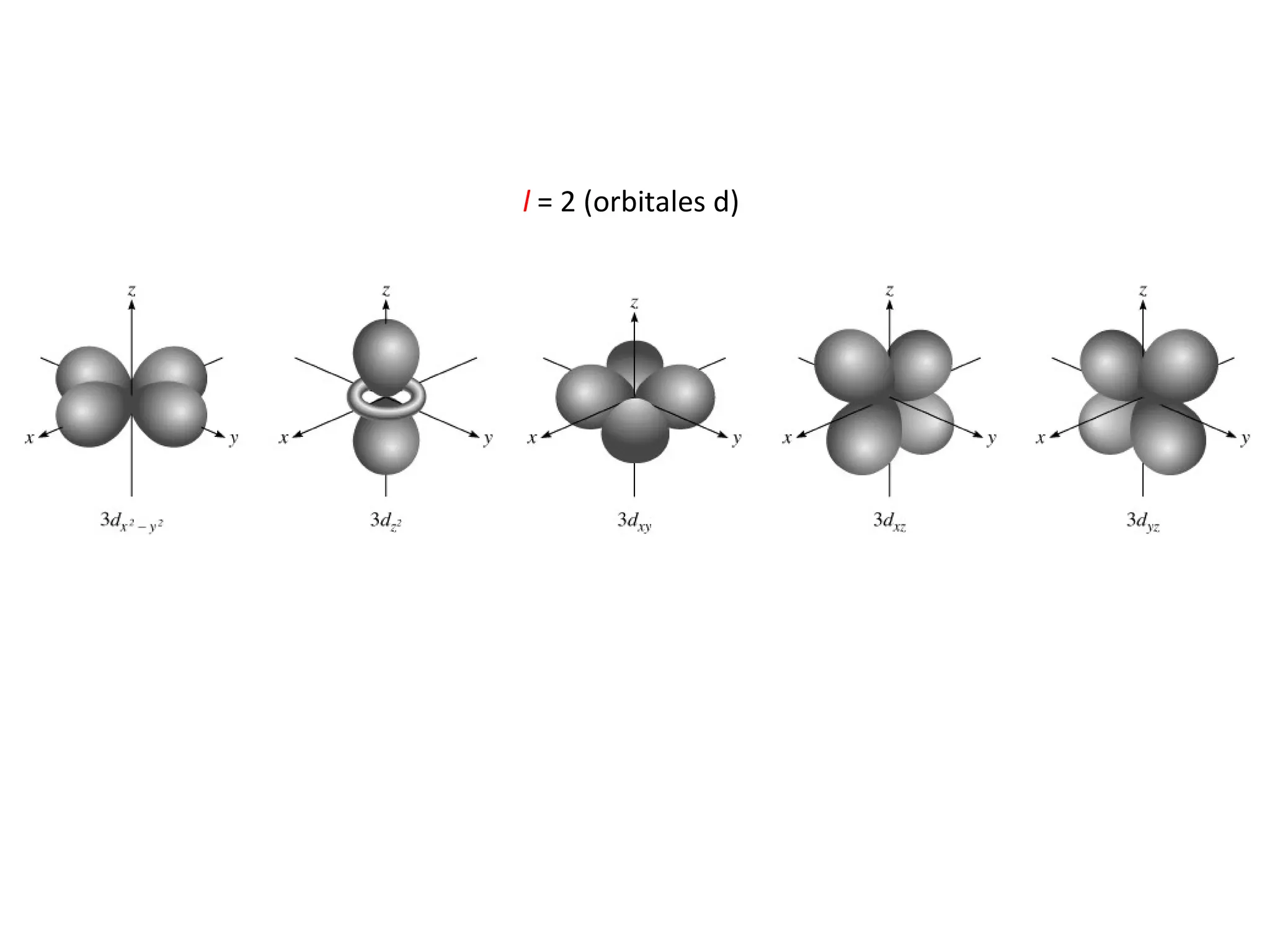
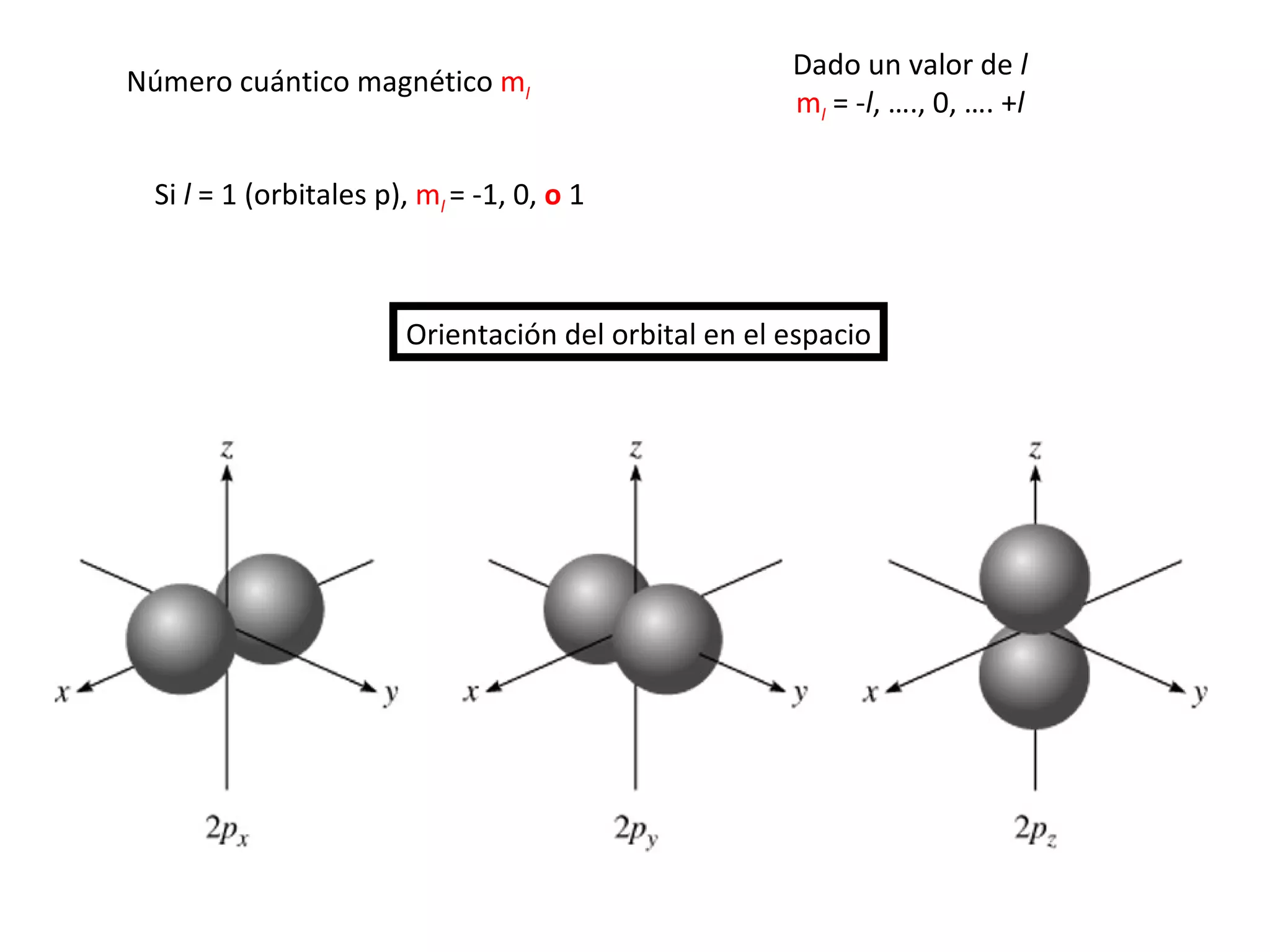
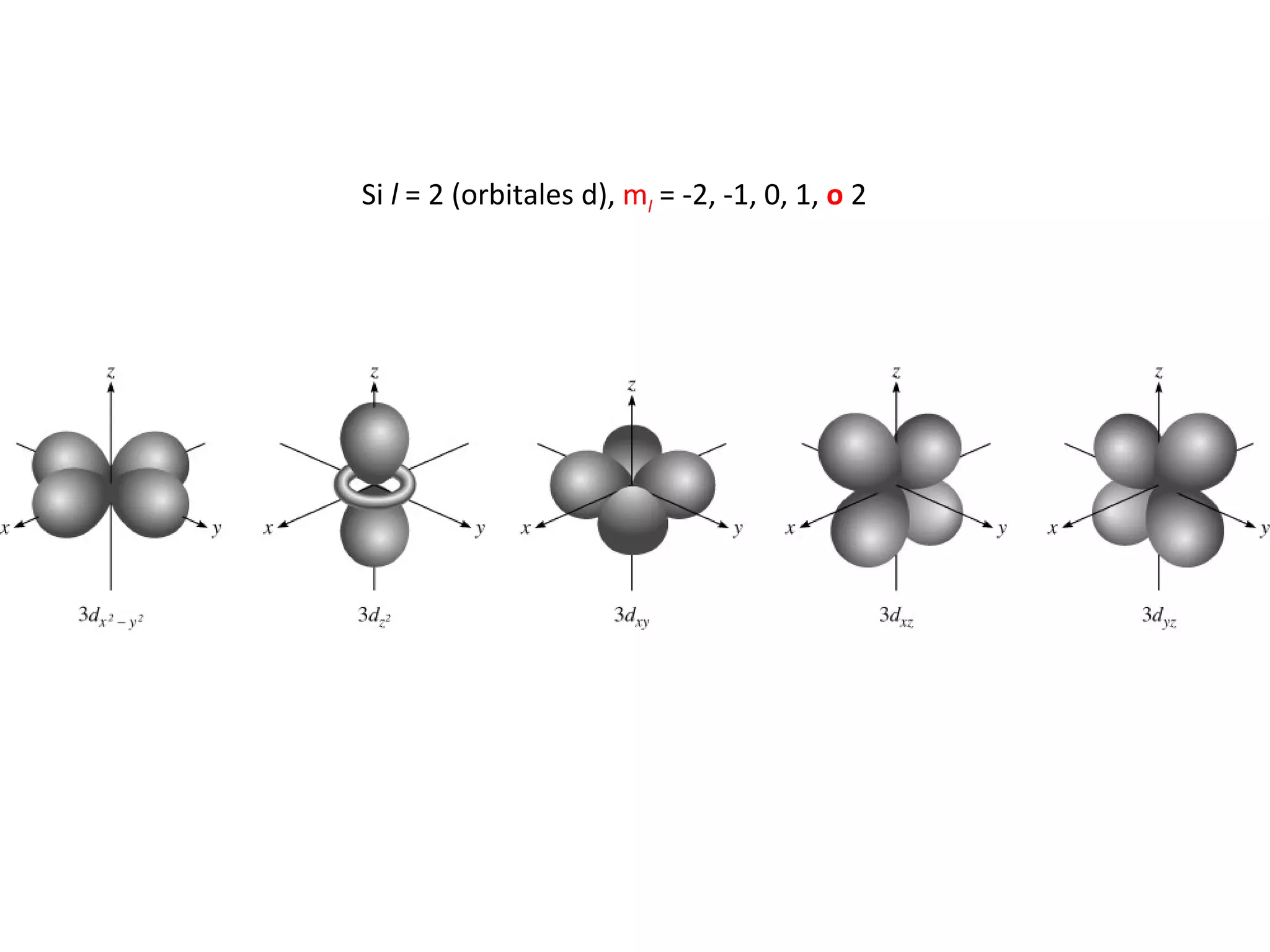
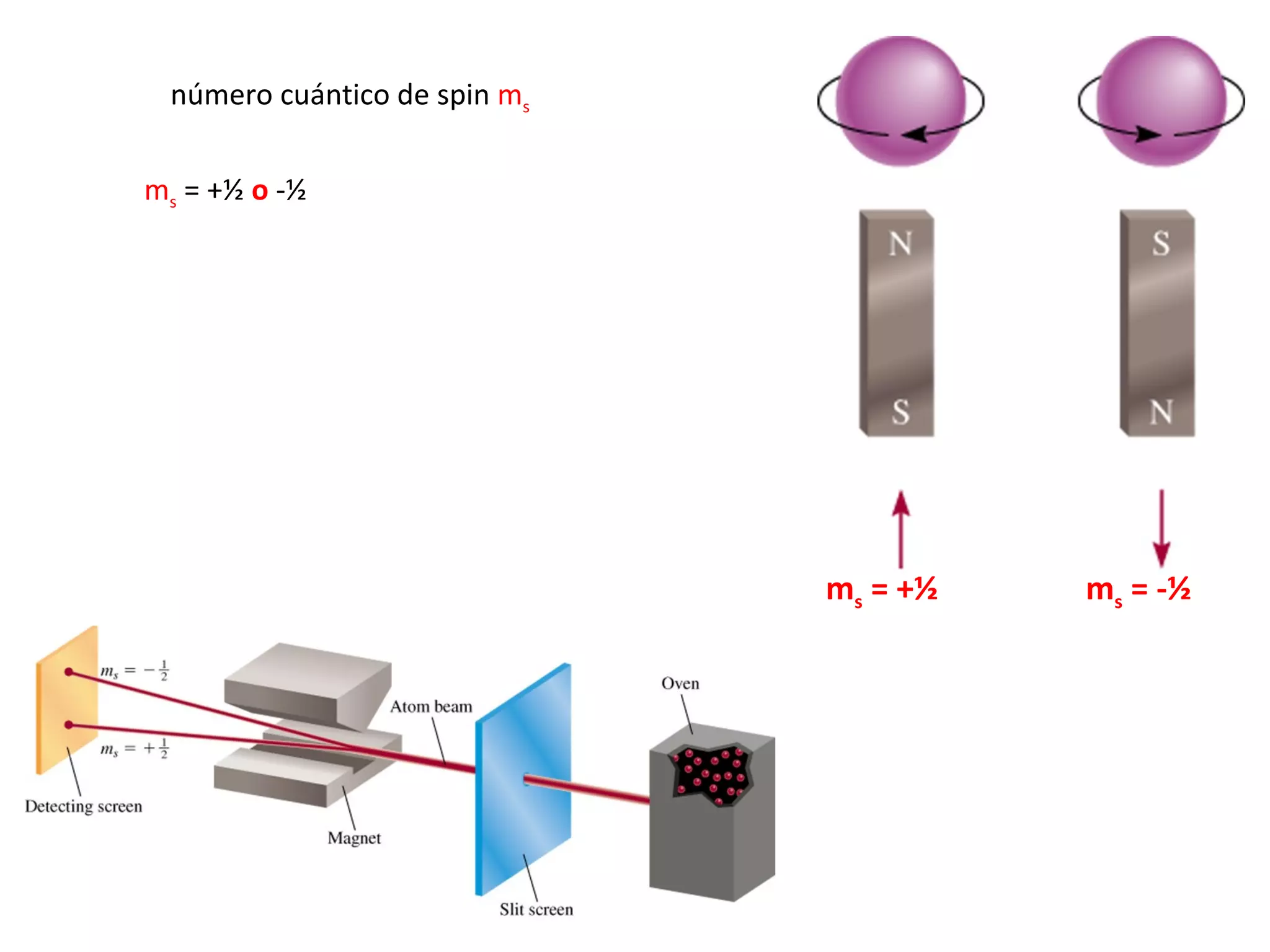
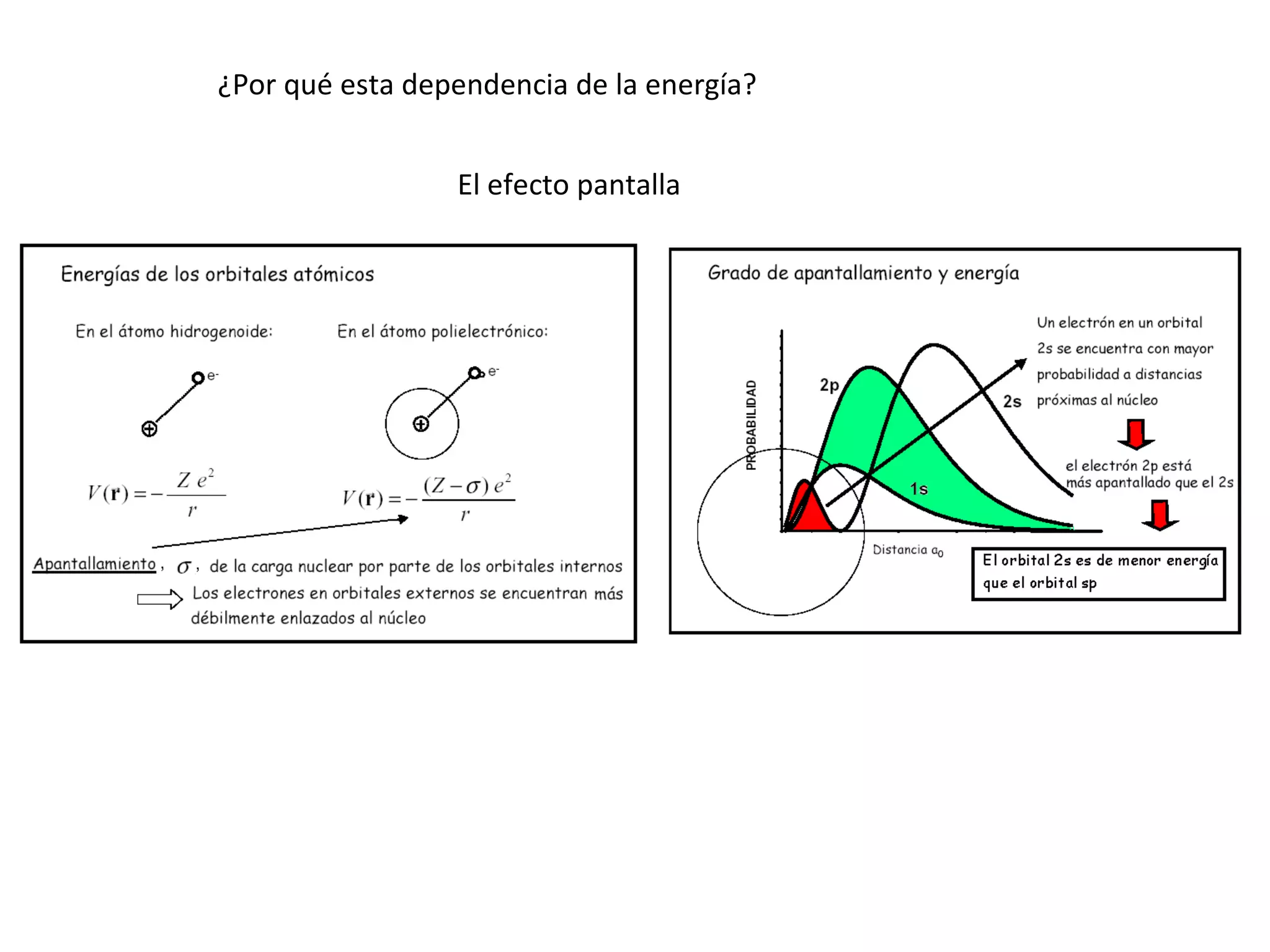
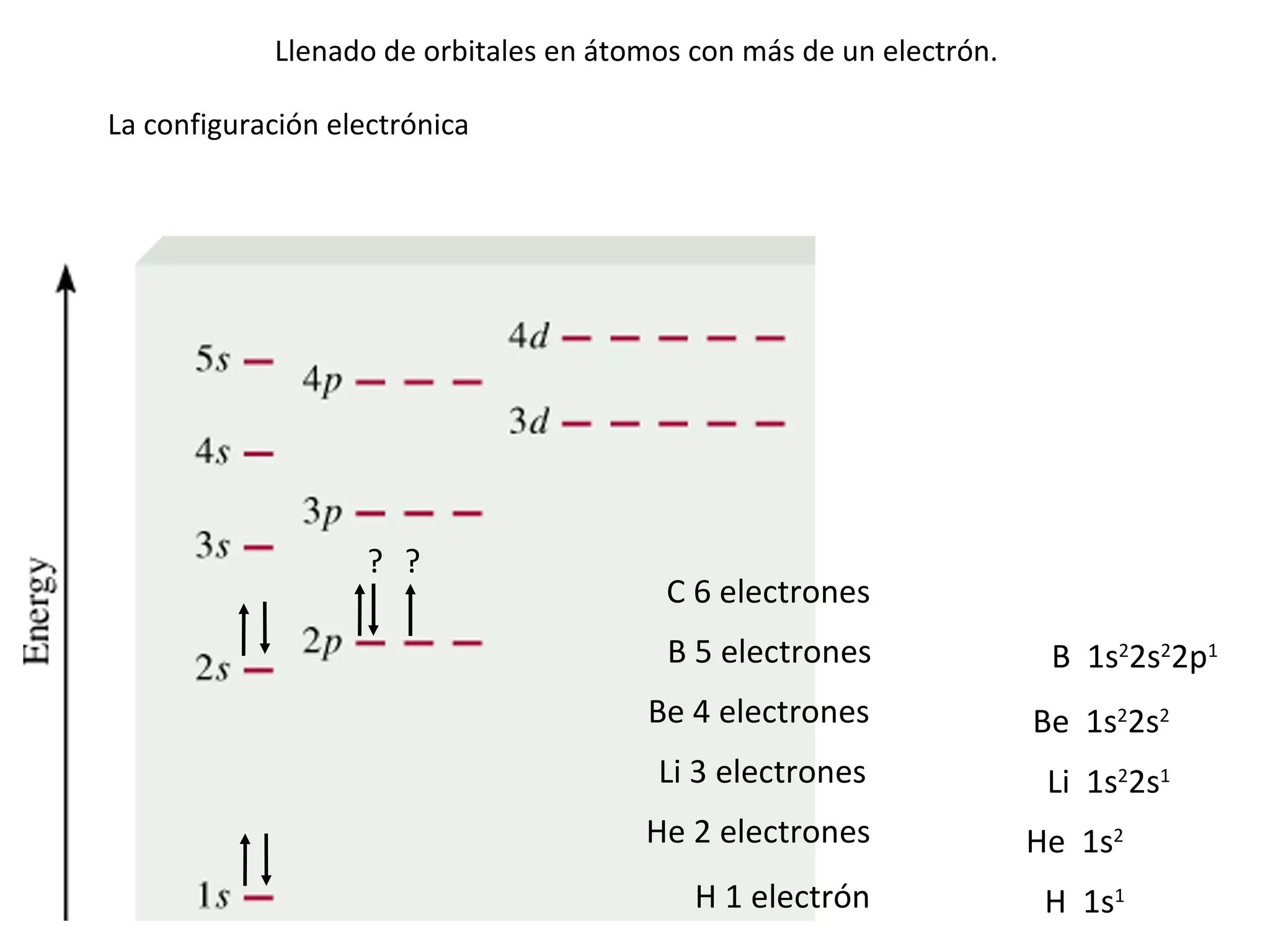
El documento describe los conceptos fundamentales de la teoría cuántica y la estructura electrónica de los átomos, incluyendo la naturaleza dual onda-partícula de la luz y los electrones, los modelos atómicos de Rutherford y Bohr, los números cuánticos y orbitales electrónicos, y cómo estos conceptos explican las líneas espectrales atómicas y la tabla periódica.














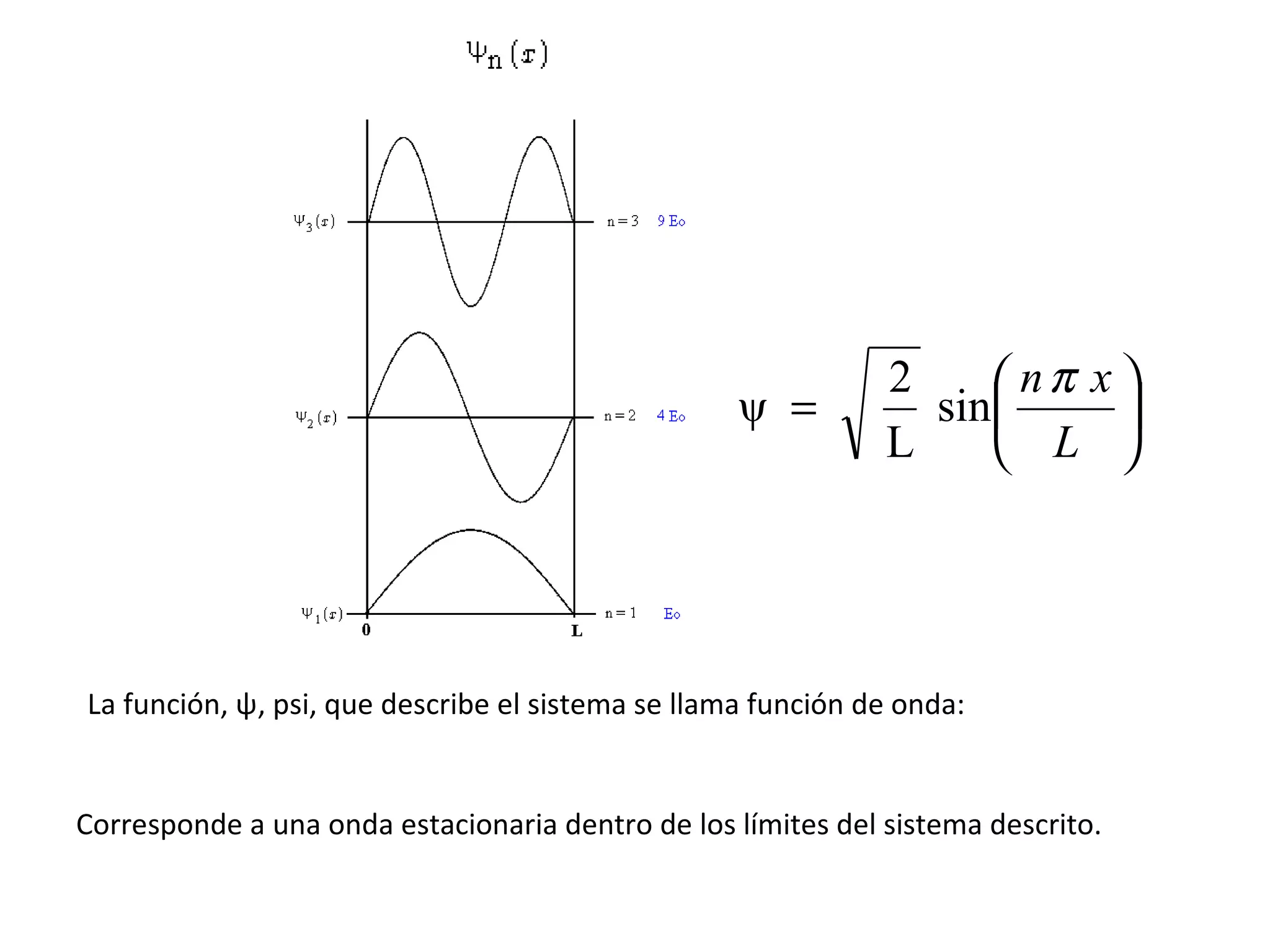
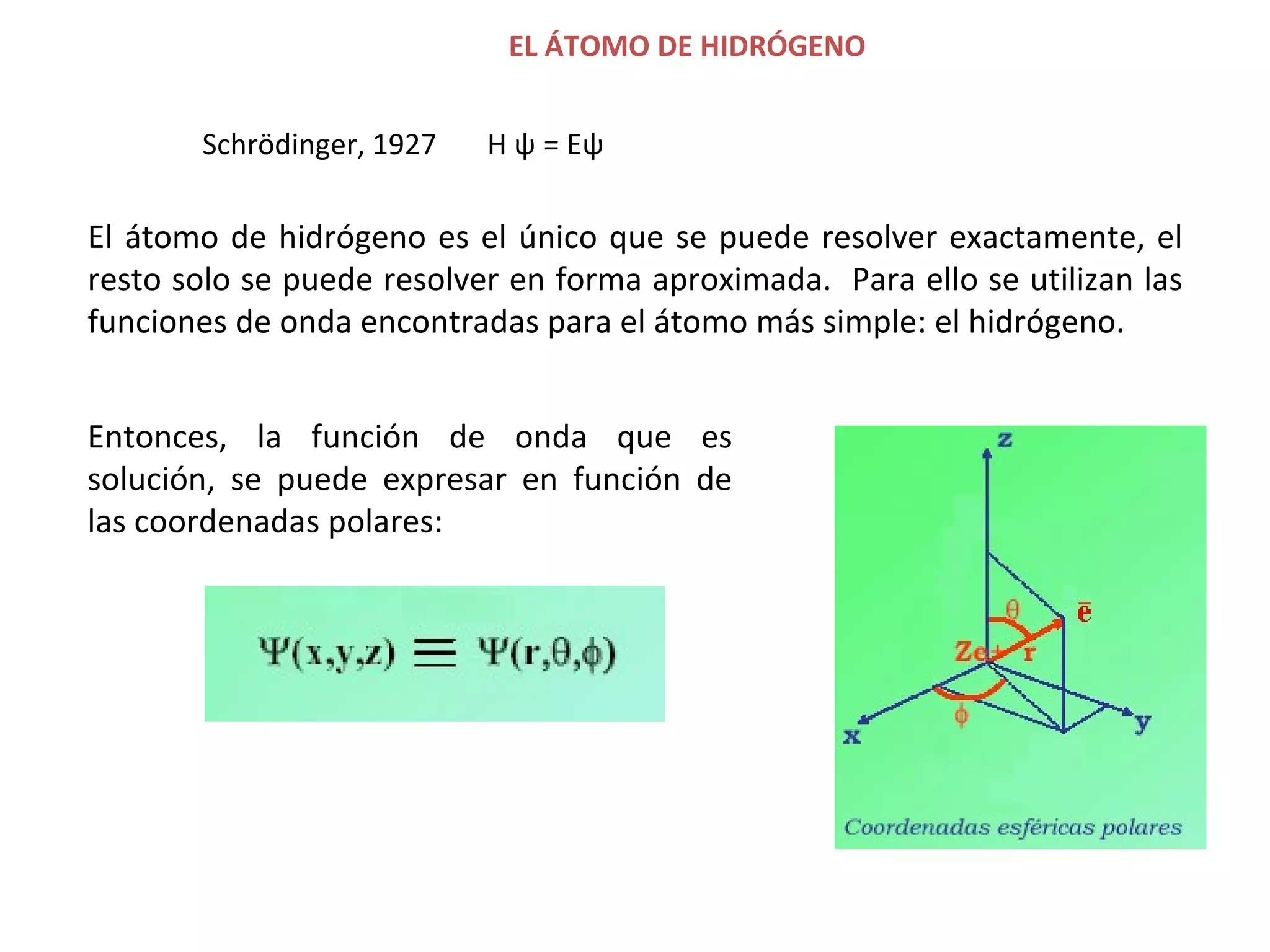



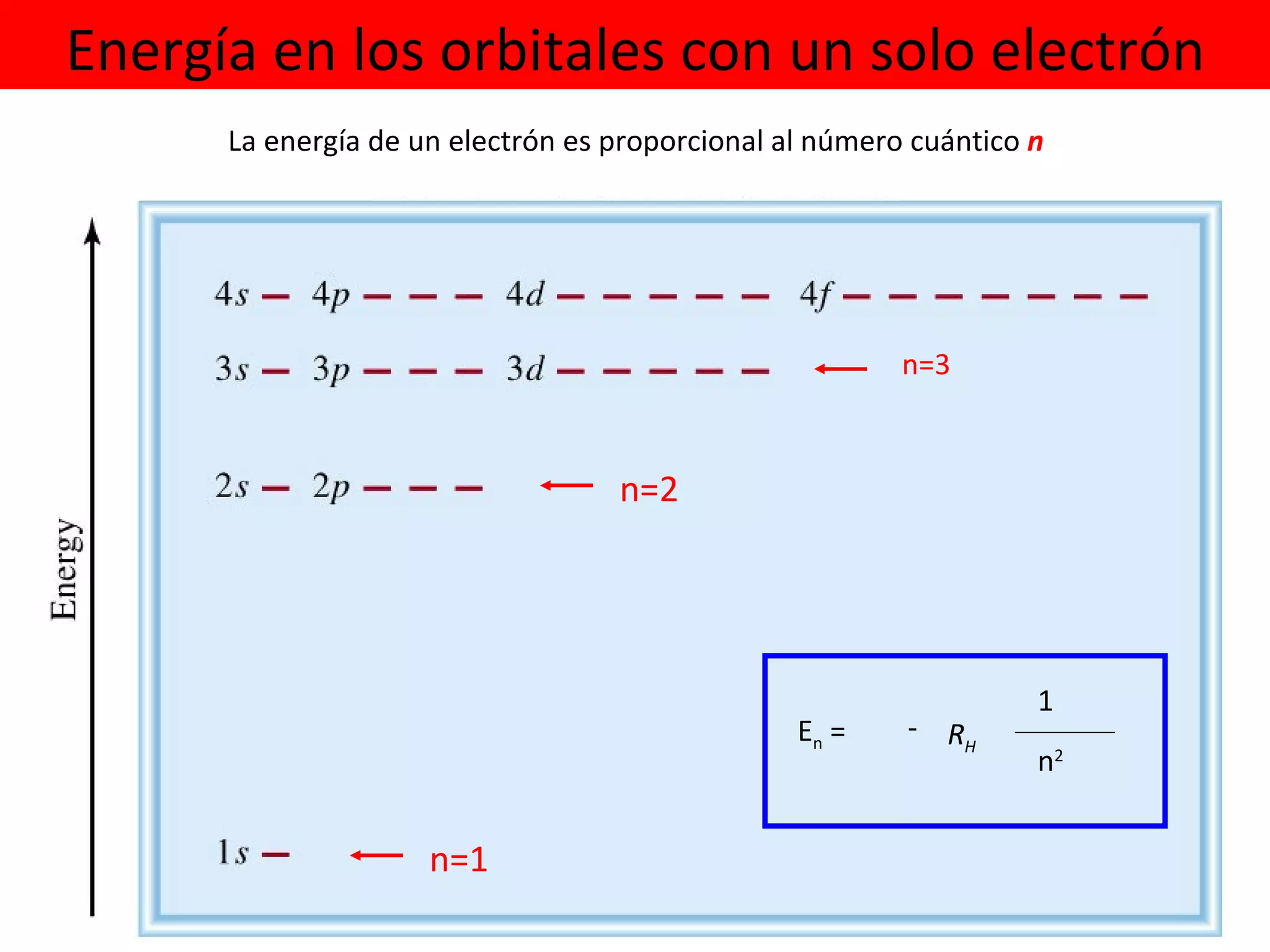
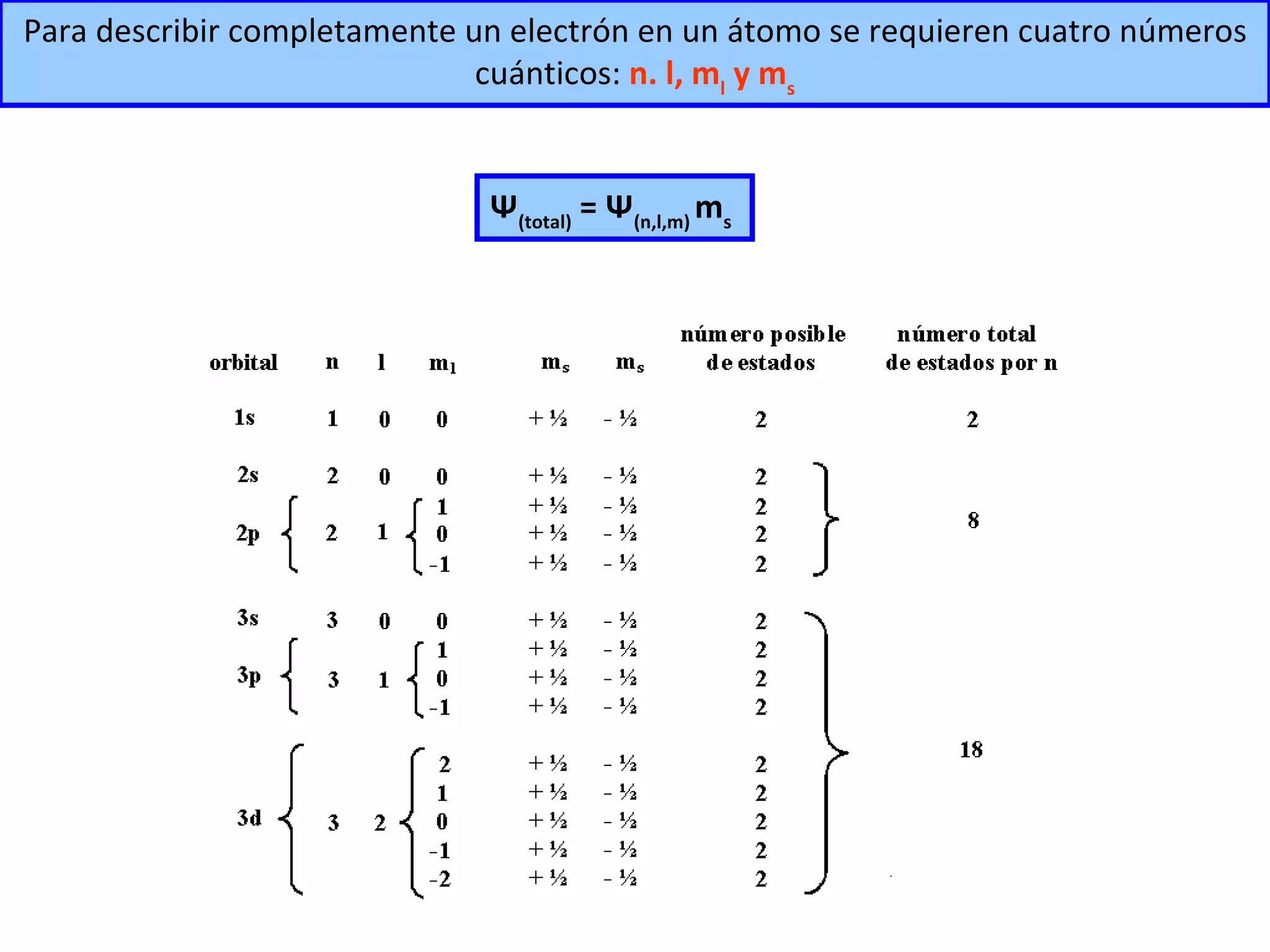
![A cada estado de movimiento definido por la función de onda le corresponde una determinada energía. = fn(n, l , m l , m s ) El electrón en el átomo de hidrógeno queda descrito entonces por su función de onda. Para el átomo de hidrógeno la energía depende sólo del número cuántico n, y queda dada por: E n = - 1 2 Z 2 n 2 Unidades atómicas de energía E n = - 1 n 2 [Hartree] 1 [Hartree] = 4,36 x 10 -18 J R H R H = 2,18 x 10 -18 J H ψ = E ψ](https://image.slidesharecdn.com/teoracunticayestructuraelectrnicadelostomos97-2003-090414020631-phpapp01/75/T-E-O-RI-A-C-UA-N-T-I-C-A-Y-E-S-T-R-U-C-T-U-R-A-E-L-E-C-T-RO-N-I-C-A-D-E-L-O-S-A-T-O-M-O-S-97-2003-48-2048.jpg)





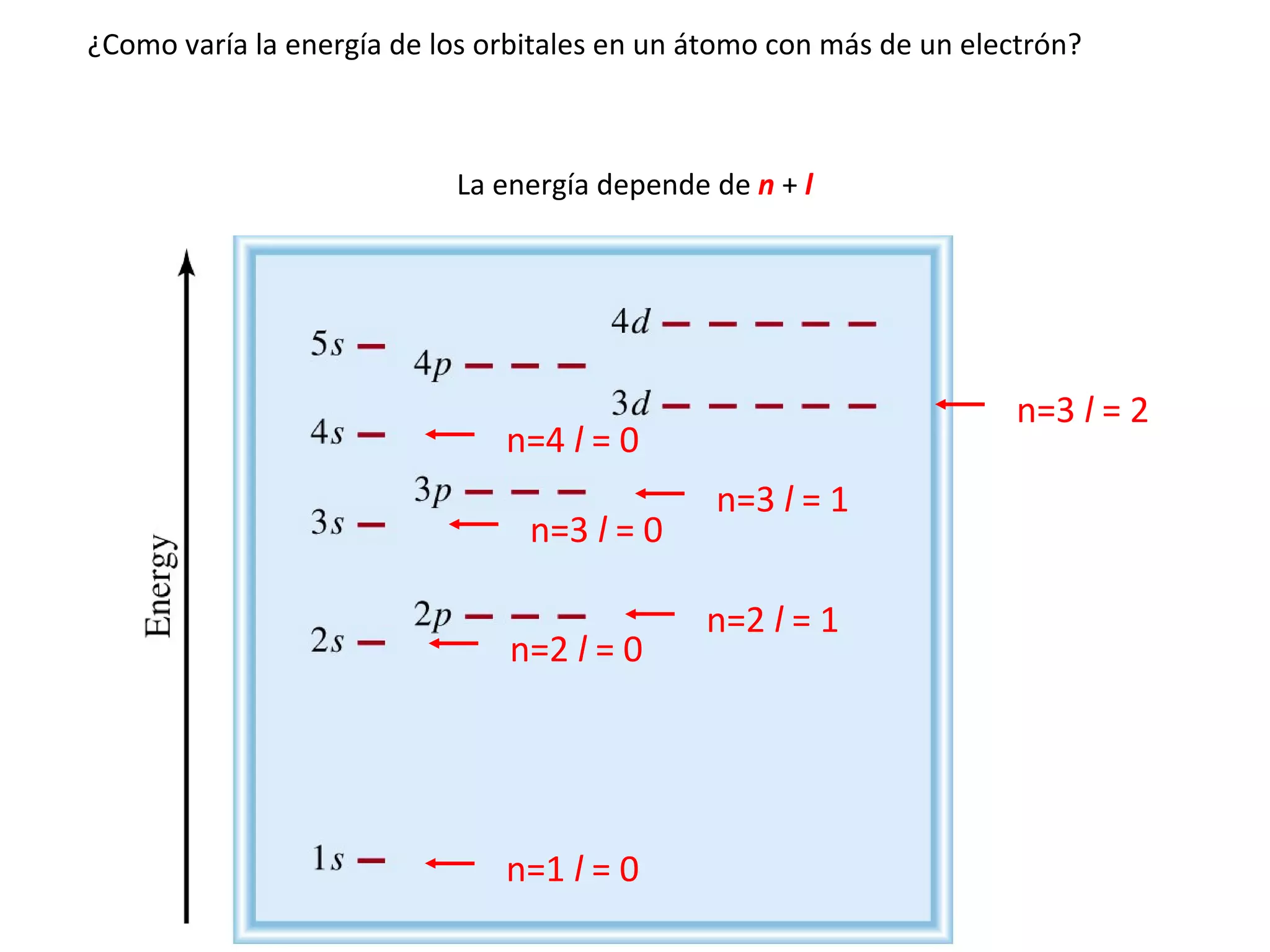
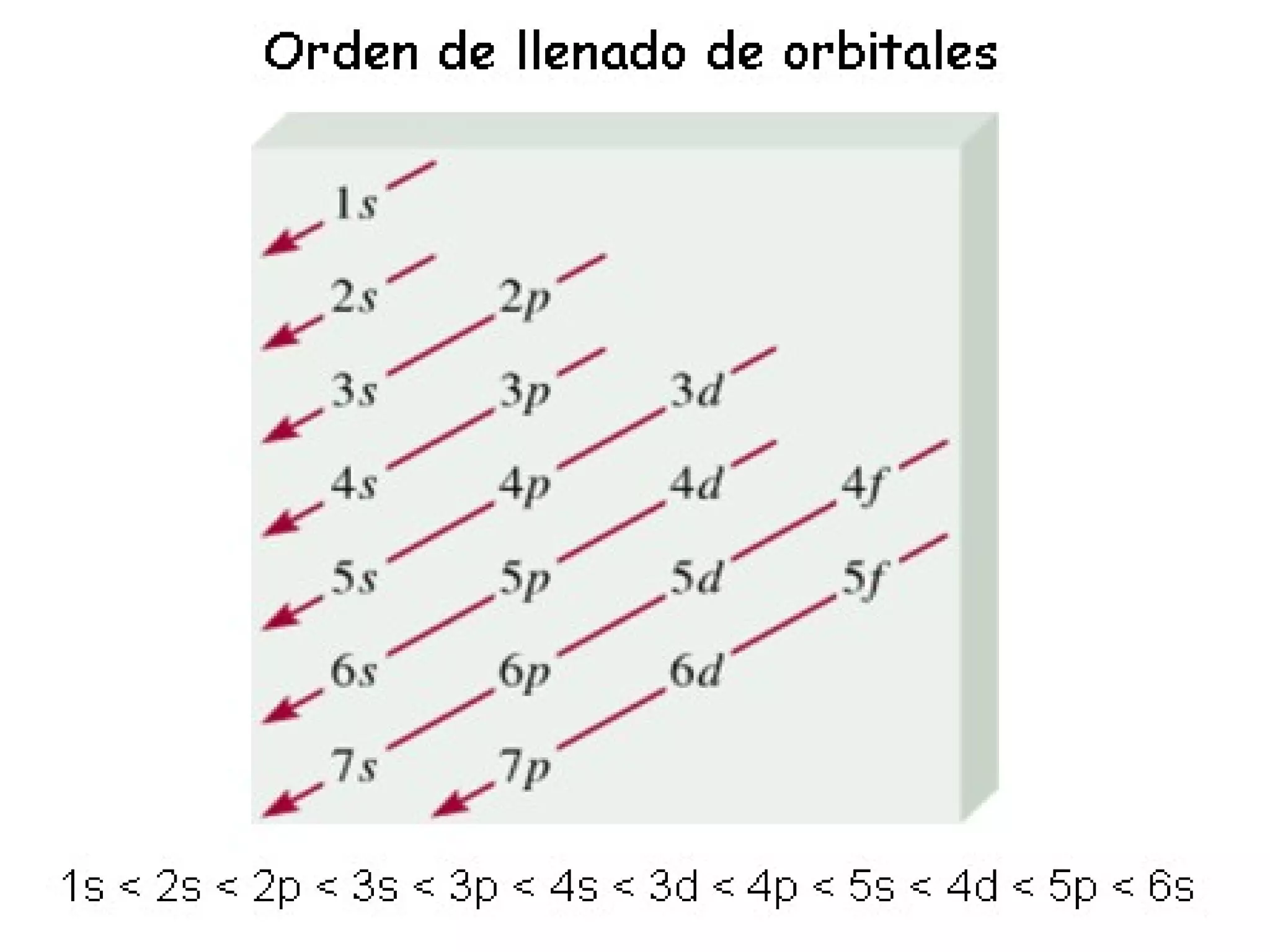

![Algunas configuraciones electrónicas: Cr [Ar]4s 1 3d 5 y no [Ar]4s 2 3d 4 Cu, Ag, Au : [ ] ns 1 (n-1)d 10 y no [ ] ns 2 (n-1)d 9 Ni [Ar] 4s 2 3d 8 Pd [ Kr ] 5 s 1 4 d 9 Pt [ Kr ] 5 d 10 Ni 2+ [Ar] 4s 0 3d 8 Ni 2+ [Ar] 3d 8 En general las situaciones de capa llena o semillena son de mayor estabilidad y de menor energía.](https://image.slidesharecdn.com/teoracunticayestructuraelectrnicadelostomos97-2003-090414020631-phpapp01/75/T-E-O-RI-A-C-UA-N-T-I-C-A-Y-E-S-T-R-U-C-T-U-R-A-E-L-E-C-T-RO-N-I-C-A-D-E-L-O-S-A-T-O-M-O-S-97-2003-61-2048.jpg)