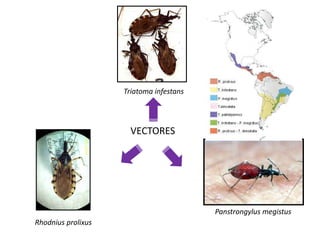
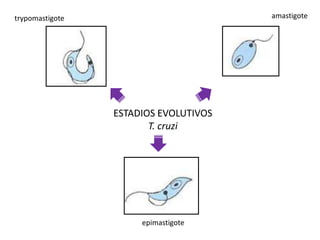
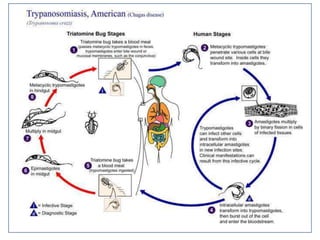
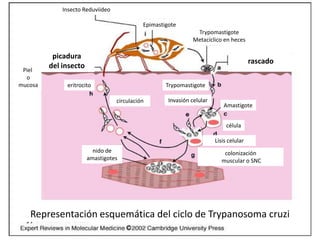
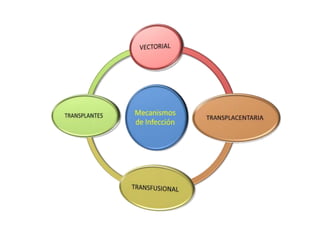
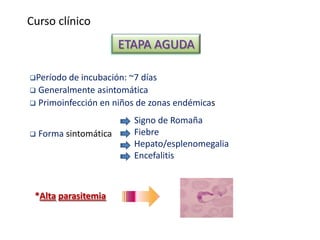
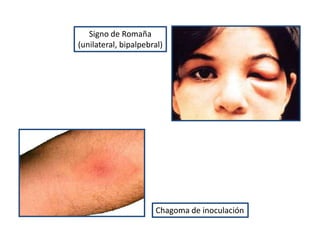
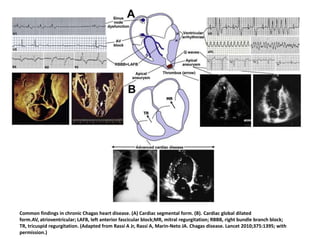
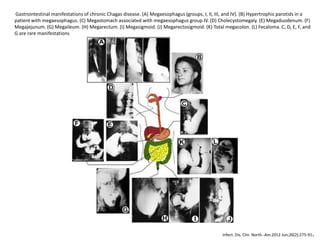
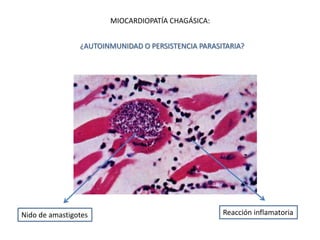
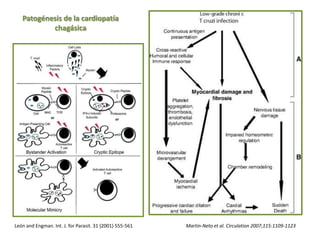
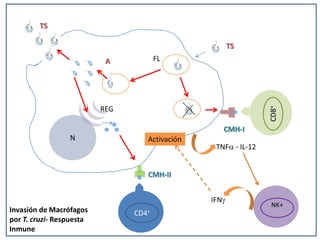
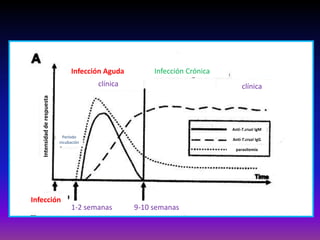
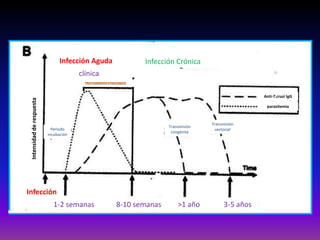
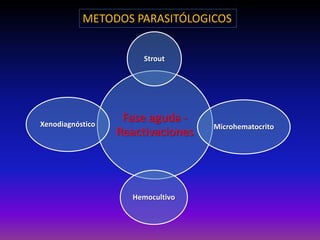
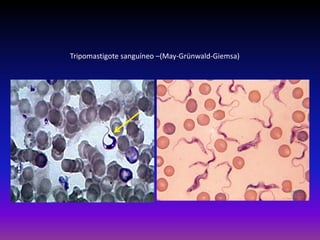
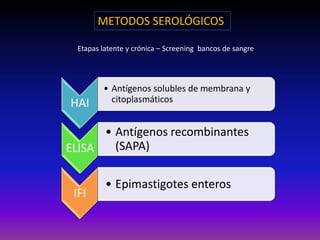
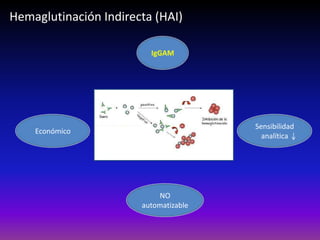
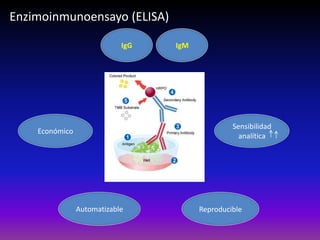
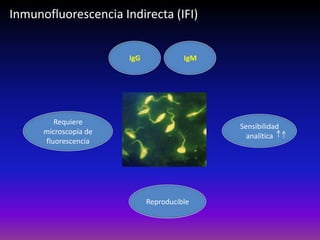
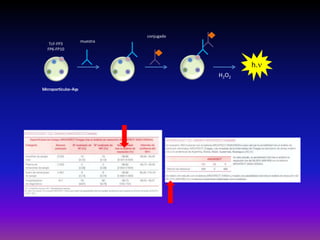
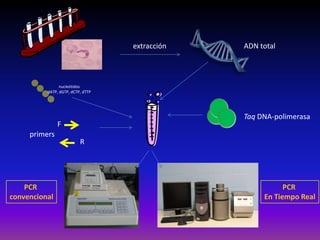
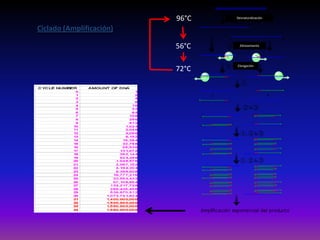
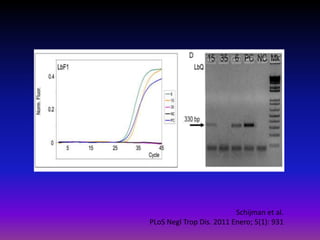
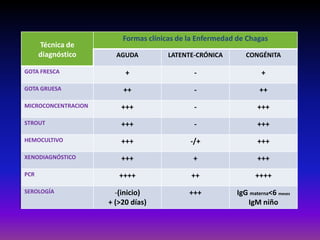
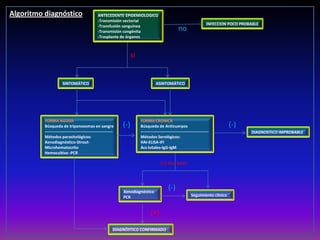
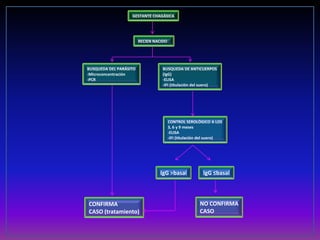
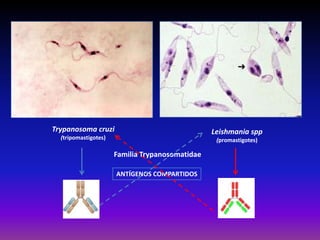
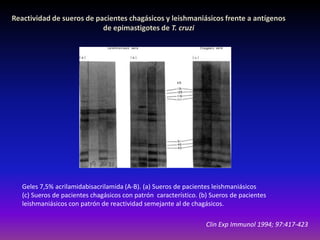
La enfermedad de Chagas es causada por el parásito Trypanosoma cruzi y transmitida principalmente por insectos. Presenta una etapa aguda, una etapa latente de 30-40 años y una etapa crónica que puede afectar el corazón y los órganos digestivos. El diagnóstico se realiza mediante métodos parasitológicos como la búsqueda del parásito en sangre durante la etapa aguda, y métodos serológicos como ELISA e IFI para detectar anticuerpos en las etapas crónicas. El tratamiento