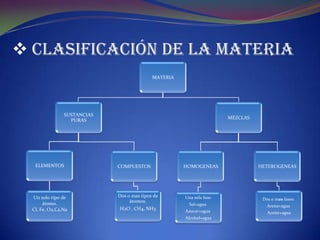
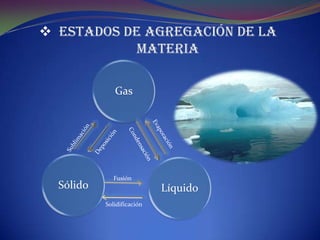
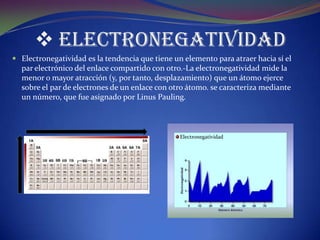
Este documento resume los conceptos fundamentales de la materia, incluyendo su clasificación, estados de agregación, propiedades físicas y químicas, átomos y partículas subatómicas. También describe el desarrollo de la tabla periódica y conceptos clave como números atómicos, grupos y períodos, tipos de elementos, radio atómico y electronegatividad.