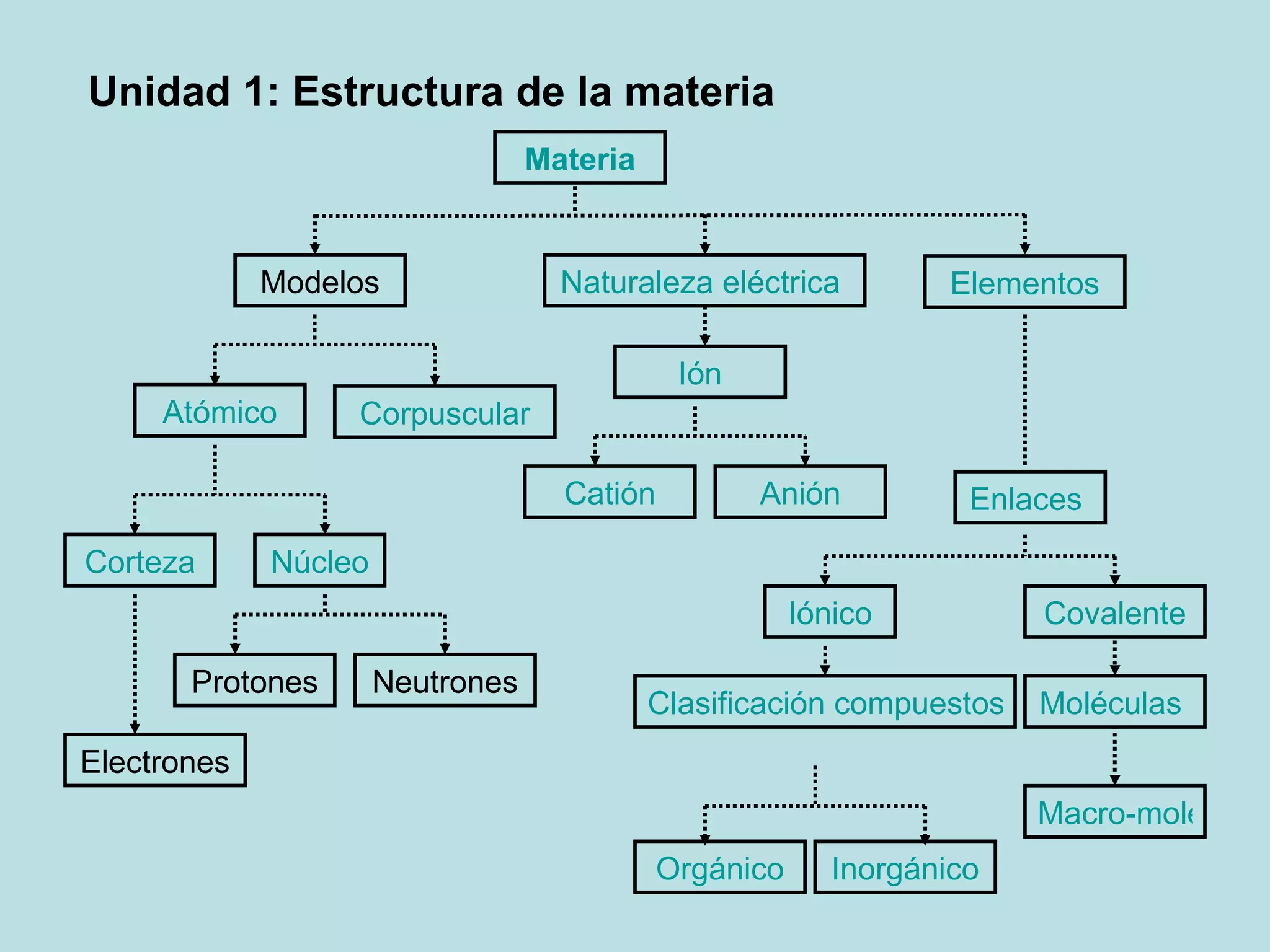
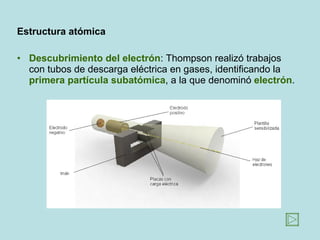
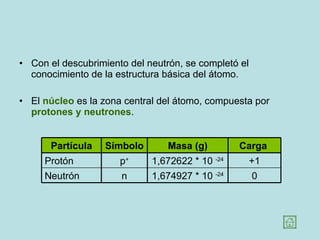
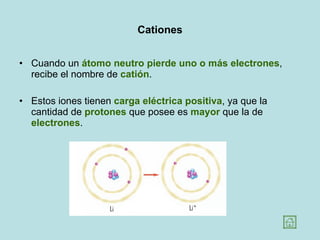
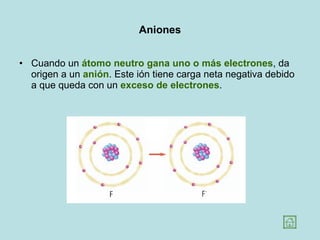
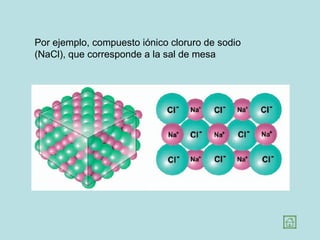
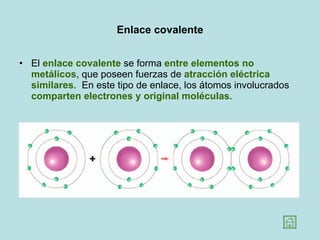
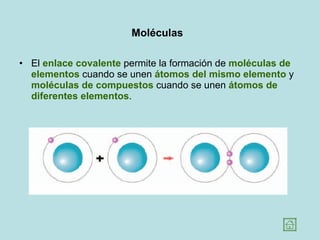
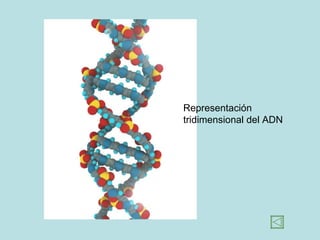
Este documento presenta los conceptos fundamentales de la estructura de la materia. Explica que la materia está compuesta de átomos y moléculas, y describe los modelos atómicos históricos como el de Thomson, Rutherford y Bohr. También define los principales tipos de enlaces como el iónico y covalente, e introduce los conceptos de iones, elementos, compuestos orgánicos e inorgánicos y macromoléculas.