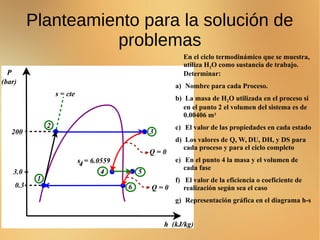
1. Se presenta un problema clásico de termodinámica que involucra un ciclo termodinámico con H2O como sustancia de trabajo. Se pide determinar varias propiedades del sistema en cada estado, así como los valores de trabajo, calor y eficiencia del ciclo.
2. Se recomienda organizar la información en una tabla y realizar cálculos de interpolación para determinar propiedades donde se requiera.
3. El análisis del ciclo involucra 6 procesos identificados y el cálculo de las propied





![Es decir s2 = s1 = 0.9441 [ kJ / kg K ]
Con los datos de
P2 = 200 bar y
s2 = 0.9441 [ kJ / kg K ]
Vamos a la tabla de Líquido
comprimido Pag. (19 tablas)](https://image.slidesharecdn.com/ejer9pag58-150502222222-conversion-gate02/85/Ejer9-pag58-7-320.jpg)


![yi=
( y 2− y1)
(x 2−x 1)
( xi−x 1)+ y1 yi=
( xi−x 1)
(x2−x 1)
( y 2− y1)+ y 1
La expresión de la derecha es igual a la de la izquierda, salvo que, como se puede
observar la división de la derecha no cambia y por lo tanto basta obtenerlo una vez.
T 2=
(0.9441−0.8205)
(1.0623−0.8205)
(80−60)+60=70.2233
T 2=0.511166(80−60)+60=70.2233
Por lo tanto para las demás propiedades, quedaría:
v 2=0.511166(0.00102−0.00101)+0.00101=0.001015[m3/ kg]
u2=0.511166(330.38−247.66)+247.66=289.9436[kJ /kg]
h2=0.511166(350.78−267.82)+267.82=310.22[kJ /kg]](https://image.slidesharecdn.com/ejer9pag58-150502222222-conversion-gate02/85/Ejer9-pag58-10-320.jpg)


![Ya conociendo la calidad y la humedad se calculan las demás
propiedades con los datos de la zona de mezcla a 3 bar (pag 10
Tablas)
v4=vg x−vf h=(0.60576∗0.8241)+(0.001073∗0.17588)=0.4994[m3/ kg]
u4=ug x−uf h=2194.57[kJ /kg]
h4=hg x−hf h=2344.37[kJ /kg]
La tabla ahora se ve de la siguiente manera](https://image.slidesharecdn.com/ejer9pag58-150502222222-conversion-gate02/85/Ejer9-pag58-13-320.jpg)
![El proceso de 5 a 6, también es adiabático (isoentropico )
S5 = s6 = 7.7675 [kJ/ kg K]
P5 = 3 bar
S5 = 7.7675 [kJ/ kg K]
Zona Vapor sobre calentado
(pag 13 tablas)
7.7675](https://image.slidesharecdn.com/ejer9pag58-150502222222-conversion-gate02/85/Ejer9-pag58-14-320.jpg)
![El mismo Procedimiento de interpolación que en el punto 2
yi=
( xi−x 1)
(x2−x 1)
( y 2− y1)+ y 1
T5=
(7.7675−7.7037)
(7.7738−7.7037)
(320−300)+300=318.2025o
C
v5=0.910128(0.90672−0.87534)+0.87534=0.90389[m3/kg]
u5=0.910128(2836.41−2806.98)+2806.98=2833.76[kJ /kg]
h5=0.910128(3110.43−3069.58)+3069.58=3106.75[kJ /kg]](https://image.slidesharecdn.com/ejer9pag58-150502222222-conversion-gate02/85/Ejer9-pag58-15-320.jpg)





