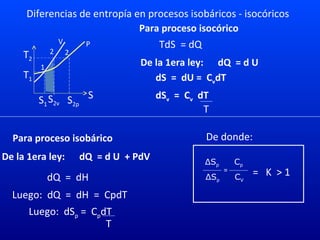
Este documento trata sobre el cambio de entropía en una sustancia pura. Explica que la entropía es una medida de la transformación de energía en mecánica según la segunda ley de la termodinámica. Describe diferentes procesos termodinámicos como isotérmicos, isobáricos e isentrópicos y cómo afectan al cambio de entropía. También presenta cuatro problemas de cálculo relacionados con el cambio de entropía en procesos termodinámicos.