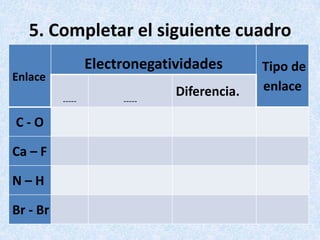
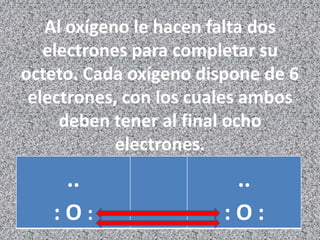
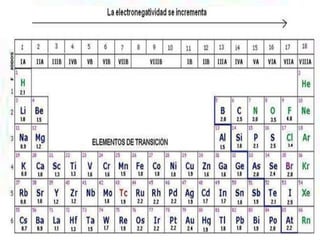
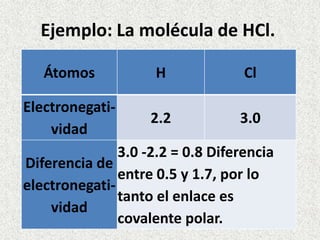
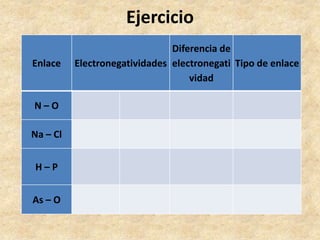
Los enlaces químicos son las fuerzas que mantienen unidos a los átomos. Existen dos tipos principales de enlaces: iónicos y covalentes. Los enlaces iónicos se forman entre un metal y un no metal, donde el metal cede electrones para formar cationes e iones negativos. Los enlaces covalentes se forman por la compartición de electrones entre no metales. La polaridad de los enlaces covalentes depende de la diferencia en electronegatividad entre los átomos unidos.















![La estructura de Lewis del compuesto
se representa de la siguiente forma:
[ Na ]
[F]
1-
1+](https://image.slidesharecdn.com/enlacesqumicos-140225071125-phpapp01/85/Enlaces-quimicos-16-320.jpg)


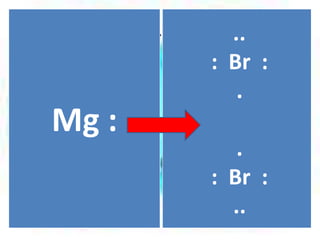
![El átomo de Mg pierde sus 2 e- de
valencia, y cada Br acepta uno para
completar el octeto.
[Mg]
2+
.. 1- .. 1[:Br:] [:Br:]
..
..](https://image.slidesharecdn.com/enlacesqumicos-140225071125-phpapp01/85/Enlaces-quimicos-21-320.jpg)









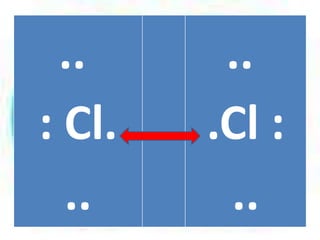






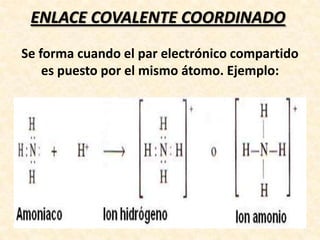
![Para el ion
amonio
[NH4]
+
tres de los enlaces son
covalentes típicos, pero en el
cuarto enlace el par de
electrones es proporcionado
por el nitrógeno, por lo tanto, el
enlace es covalente
coordinado.](https://image.slidesharecdn.com/enlacesqumicos-140225071125-phpapp01/85/Enlaces-quimicos-44-320.jpg)