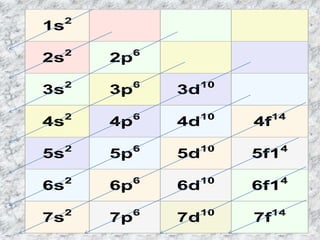
Este documento explica la distribución electrónica de los átomos, incluyendo cómo se representan los electrones en los subniveles y orbitales atómicos según el diagrama de Moseley. También describe cómo usar la distribución electrónica para determinar el número de electrones de valencia, el período y el grupo de un elemento en la tabla periódica.