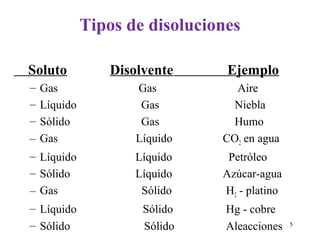
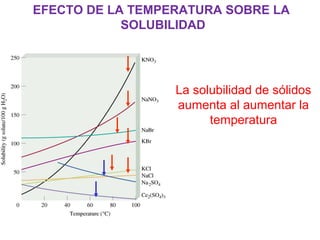
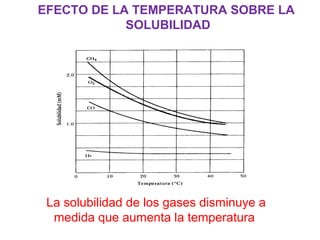
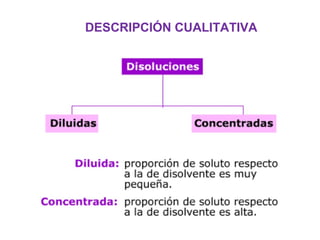
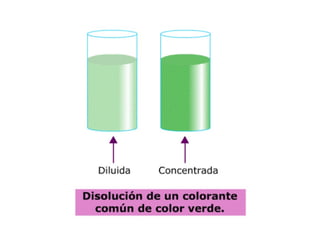
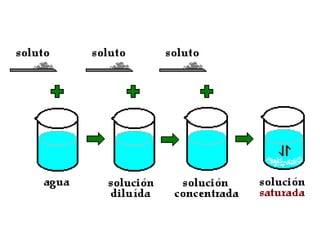
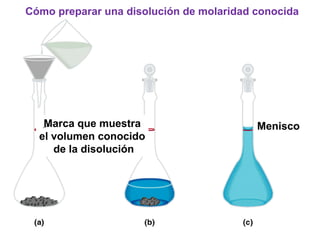
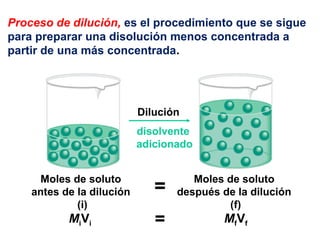
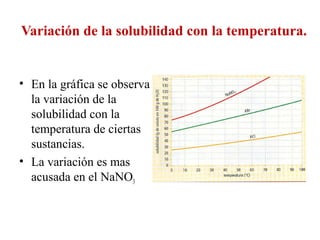
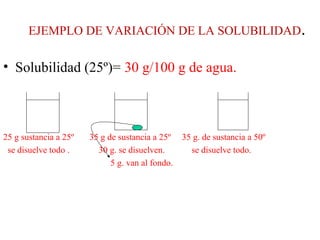
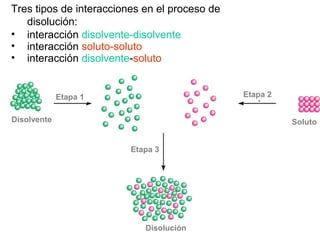
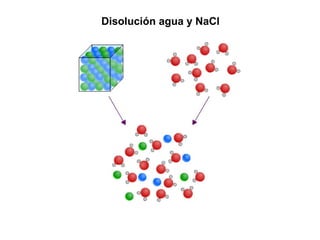
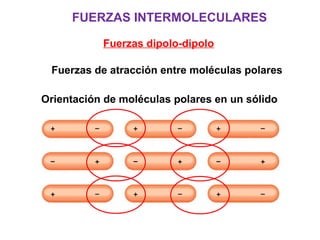
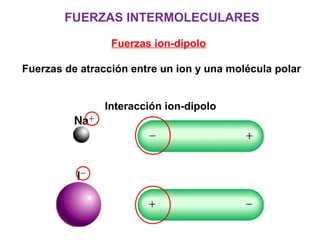
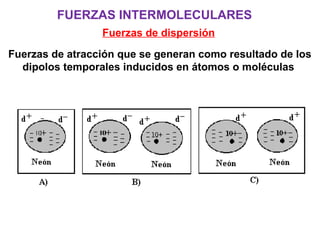
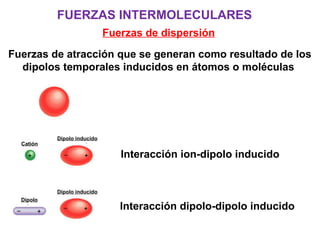
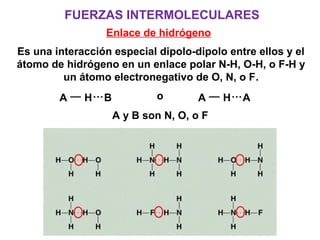
Este documento resume los conceptos fundamentales de las disoluciones acuosas y mezclas homogéneas. Explica que una disolución es una mezcla homogénea de dos o más sustancias donde el soluto se disuelve en el disolvente. También describe los diferentes tipos de disoluciones, los factores que afectan la solubilidad como la temperatura y presión, y los principios de solubilidad basados en las fuerzas intermoleculares entre sustancias.