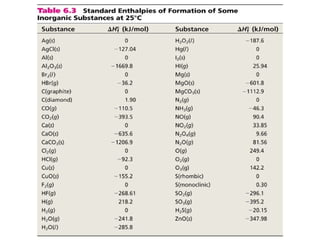
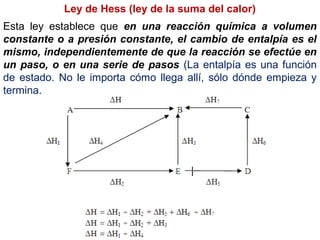
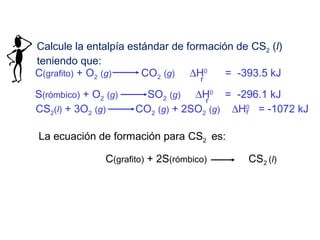
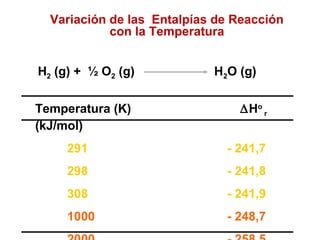
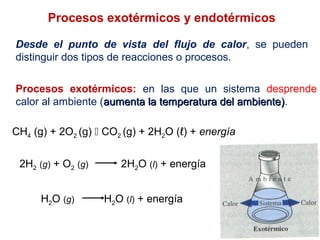
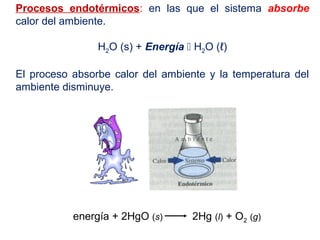
Este documento trata sobre la termoquímica, que estudia el flujo de calor asociado a reacciones químicas y cambios físicos. Explica conceptos como procesos exotérmicos y endotérmicos, entalpía, entalpía estándar de formación y de reacción, calor de combustión, calor de neutralización, y la ley de Hess. Además, incluye ejemplos de cálculos termoquímicos.














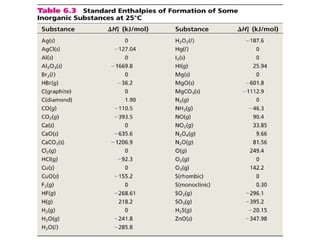
![La entalpía estándar de reacción (∆H0
) es la entalpía
de una reacción química llevada a cabo a 25ºC y 1 atm.
reacción
aA + bB cC + dD
∆H0
reaccion d∆H0
(D)fc∆H0
(C)f= [ + ] - b∆H0
(B)fa∆H0
(A)f[ + ]
∆H0
n∆H0
(productos )f= Σ m∆H0
(reactivos)fΣ-
Se puede calcular a partir de los ΔHo
f de compuestos
n y m coeficientes estequiométricos de reactivos y productos.
reaccion](https://image.slidesharecdn.com/termoqumica-101031221439-phpapp01/85/Termoquimica-18-320.jpg)