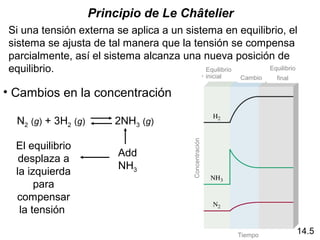
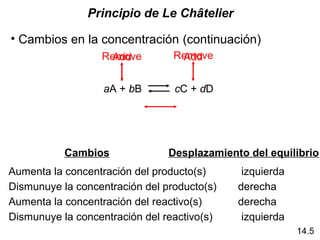
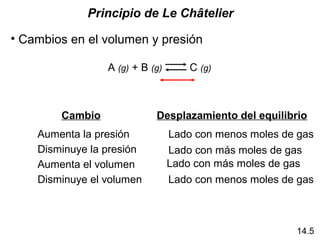
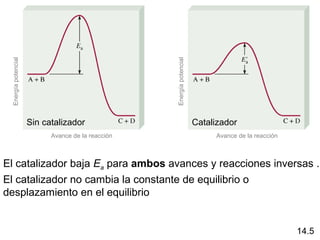
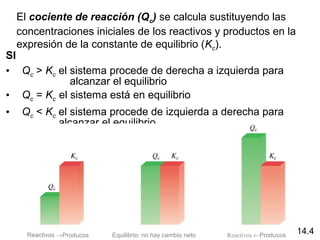
Este documento trata sobre el equilibrio químico. Explica que el equilibrio químico se alcanza cuando las velocidades de las reacciones directa e inversa son iguales y las concentraciones de los reactivos y productos permanecen constantes. También distingue entre equilibrio homogéneo, que aplica a reacciones donde todas las especies están en la misma fase, y equilibrio heterogéneo, que aplica a reacciones donde los reactivos y productos están en fases diferentes. Además, explica cómo calcular las constantes


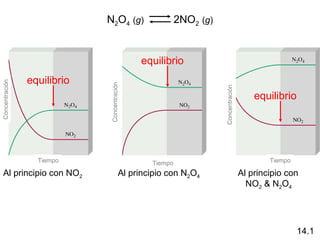
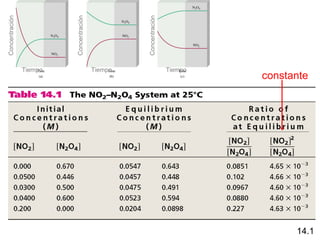
![N2O4 (g) 2NO2 (g)
[NO2]2
K= = 4.63 x 10-3
[N2O4]
aA + bB cC + dD
[C]c[D]d
K= Ley de acción de masa
[A]a[B]b
El equilibrio será
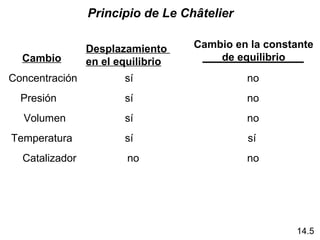
K >> 1 Desplaza a la derecha Favorece a los productos
K << 1 Desplaza a la derecha Favorece a las productos
14.1](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-5-320.jpg)
![El equilibrio homogéneo se aplica a las reacciones en que
todas las especies reactivas están en la misma fase.
N2O4 (g) 2NO2 (g)
[NO2] 2 P2
NO 2
Kc = Kp =
[N2O4] P O
N
2 4
En la mayoría de los casos
Kc ≠ Kp
aA (g) + bB (g) cC (g) + dD (g)
Kp = Kc(RT)∆n
∆n = moles de productos gaseosos – moles de reactivos gaseosos
= (c + d) – (a + b)
14.2](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-6-320.jpg)
![Equilibrio homogéneo
CH3COOH (ac) + H2O (l) CH3COO- (ac) + H3O+ (ac)
[CH3COO-][H3O+]
K‘ = [H2O] = constante
c
[CH3COOH][H2O]
[CH3COO-][H3O+]
Kc = = K‘ [H2O]
c
[CH3COOH]
En la práctica general no se incluyen
unidades para la constante de equilibrio.
14.2](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-7-320.jpg)
![Las concentraciones de equilibrio para la reacción entre
monóxido de carbono y cloro molecular para formar COCl2
(g) a 740C son [CO] = 0.012 M, [Cl2] = 0.054 M, y
[COCl2] = 0.14 M. Calcule las constantes de equilibrio Kc y
Kp.
CO (g) + Cl2 (g) COCl2 (g)
[COCl2] 0.14
Kc = = = 220
[CO][Cl2] 0.012 x 0.054
Kp = Kc(RT)∆n
∆n = 1 – 2 = -1 R = 0.0821 T = 273 + 74 = 347 K
Kp = 220 x (0.0821 x 347)-1 = 7.7
14.2](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-8-320.jpg)

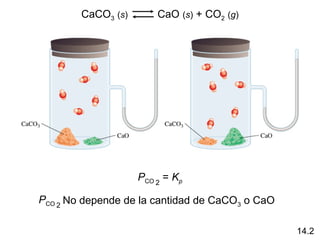
![El equilibrio heterogéneo se aplica a las reacciones en que
los reactivos y productos están en diferentes fases .
CaCO3 (s) CaO (s) + CO2 (g)
[CaO][CO2] [CaCO3] = constante
K‘ =
c
[CaCO3] [CaO] = constante
[CaCO3]
Kc = [CO2] = K‘ x Kp = PCO2
c
[CaO]
La concentración de sólidos y líquidos puros no son
incluidos en la expresión para la constante de equilibrio.
14.2](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-10-320.jpg)

![[C][D] [E][F]
A+B C+D K‘ K‘ = K‘‘ =
c c
[A][B] c
[C][D]
C+D E+F K‘‘
c
[E][F]
A+B E+F Kc Kc =
[A][B]
Kc = K‘ x K‘‘
c c
Si una reacción se puede expresar como la
suma de dos o más reacciones, la
constante de equilibrio para la reacción
global está dada por el producto de las
constantes de equilibrio de las reacciones
individuales.
14.2](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-13-320.jpg)
![N2O4 (g) 2NO2 (g) 2NO2 (g) N2O4 (g)
[NO2]2 [N2O4] 1
K= = 4.63 x 10 -3
K‘ = = = 216
[N2O4] [NO2] 2 K
Cuando la ecuación para una reacción
reversible se escribe en dirección opuesta,
la constante de equilibrio se vuelve el
inverso de la constante de equilibrio original.
14.2](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-14-320.jpg)

![Química cinética y equilibrio químico
kf velocidadf = kf [A][B]2
A + 2B AB2
kr velocidadr = kr [AB2]
Equilibrio
velocidadf = velocidadr
kf [A][B]2 = kr [AB2]
kf [AB2]
= Kc =
kr [A][B]2
14.3](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-16-320.jpg)

![A 12800C la constante de equilibrio (Kc) para la reacción
Br2 (g) 2Br (g)
Es 1.1 x 10-3. Si las concentraciones iniciales son [Br2] =
0.063 M y [Br] = 0.012 M, calcule las concentraciones de
estas especies en equilibrio.
Sea x el cambio en la concentración de Br2
Br2 (g) 2Br (g)
Inicial (M) 0.063 0.012
Cambio (M) -x +2x
Equilibrio(M) 0.063 - x 0.012 + 2x
[Br]2 (0.012 + 2x)2
Kc = Kc = = 1.1 x 10-3 Resuelva
[Br2] 0.063 - x para x
14.4](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-19-320.jpg)
![(0.012 + 2x)2
Kc = = 1.1 x 10-3
0.063 - x
4x2 + 0.048x + 0.000144 = 0.0000693 – 0.0011x
4x2 + 0.0491x + 0.0000747 = 0
-b ± √ b2 – 4ac
ax2 + bx + c =0 x=
2a
x = -0.0105 x = -0.00178
Br2 (g) 2Br (g)
Inicial(M) 0.063 0.012
Cambio(M) -x +2x
Equilibrio(M) 0.063 - x 0.012 + 2x
En equilibrio, [Br] = 0.012 + 2x = -0.009 M o 0.00844 M
En equilibrio, [Br2] = 0.062 – x = 0.0648 M
14.4](https://image.slidesharecdn.com/diapositivas141-130331155744-phpapp02/85/Equilibrio-Quimico-20-320.jpg)