Este documento trata sobre el equilibrio químico. Explica que un equilibrio químico ocurre cuando una reacción no se completa, sino que ocurre en ambos sentidos, formando reactivos y productos. Cuando las concentraciones de todas las sustancias involucradas se estabilizan, se alcanza el equilibrio químico. También discute conceptos como la constante de equilibrio y el significado de sus valores, así como ejemplos de equilibrios ácido-base y valoraciones ácido-base.


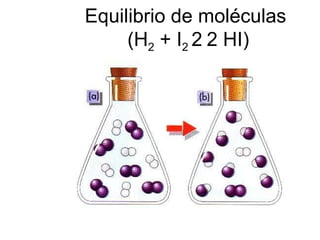
![Variación de la concentración con el tiempo (H 2 + I 2 2 HI) Equilibrio químico Concentraciones (mol/l) Tiempo (s) [HI] [I 2 ] [H 2 ]](https://image.slidesharecdn.com/equilibrioquimico1-100531202407-phpapp01/85/Equilibrio-quimico1-4-320.jpg)


















![Valoración de base fuerte con ácido fuerte Los cálculos de los puntos de la curva serían similares y la representación tendría aire inverso: Conclusiones El salto se ve afectado por el valor de las concentraciones enfrentadas Disminución [valorante] Disminución [analito] El intervalo óptimo es 0.5-0.1 M](https://image.slidesharecdn.com/equilibrioquimico1-100531202407-phpapp01/85/Equilibrio-quimico1-23-320.jpg)
![Valoraciones de ácidos o bases débiles La situación es distinta al caso anterior ya que para el cálculo del pH entran en juego distintos tipos de equilibrios dependiendo de la relación de concentraciones : ácido/base conjugada; base/ácido conjugado. En cualquier caso sólo se considerará la valoración con bases o ácidos fuertes HA + H 2 O A - + H 3 O + ácido base Ka = [A - ] [HA] [H 3 O + ] Zonas de la curva de valoración: El pH inicial lo fija la Ka o Kb El pH se corresponde con el de la disolución reguladora que se forma en el transcurso de la valoración. El PH en el P.E. Se corresponde con el de la sal formada. El pH depende del exceso de base o ácido añadido Valoración de ácido débil con base fuerte (1) (2) (3) P.E. (4)](https://image.slidesharecdn.com/equilibrioquimico1-100531202407-phpapp01/85/Equilibrio-quimico1-24-320.jpg)
![Sistemas tampón La concentración de H+ es crucial para los sistemas biológicos, fundamentalmente por sus efectos sobre las velocidades de reacciones bioquímicas y la estructura de las proteínas. El mantenimiento del pH dentro de unos límites es esencial para los seres vivos. Ej. Sangre pH=7.4 (7.35-7.45). Los cambios de pH fuera de estos márgenes pueden ser mortales. Los tampones o amortiguadores ayudan a mantener el pH relativamente constante. Impiden las variaciones de pH cuando se añaden cantidades moderadas de H + o OH - . Están formados por el par ácido débil y su base conjugada que actúan como dador y aceptor de protones respectivamente. La capacidad de un tampón para un pH específico depende: 1. La concentración molar del par ácido/base conjugada (suma de las concentraciones del ácido mas la base conjugada, [AH] + [A - ] 2. El cociente de sus concentraciones. [A-]/ [AH] La mayor eficacia de un tampón se produce cerca de su valor de pKa.](https://image.slidesharecdn.com/equilibrioquimico1-100531202407-phpapp01/85/Equilibrio-quimico1-25-320.jpg)
![AH A - + H + K a [A - ] x [H + ] K a = [AH] [A - ] x [H + ] K a x [AH] = lg ([A - ] x [H + ]) lg (K a x [AH]) = lg [A - ] + lg [H + ] lg K a + lg [AH] = -lg [H + ] = - lg Ka + lg [A - ] - lg [AH] pH = pKa + lg [A - ] [AH] Ecuación de Henderson-Hasselbach Para un ácido débil Si [A - ] = [AH], pH = pKa. El PKa es el pH al que están disociadas la mitad de las moléculas del ácido](https://image.slidesharecdn.com/equilibrioquimico1-100531202407-phpapp01/85/Equilibrio-quimico1-26-320.jpg)







