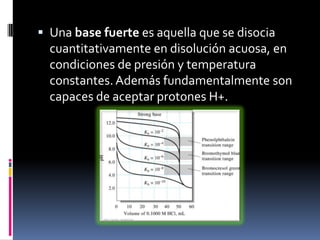
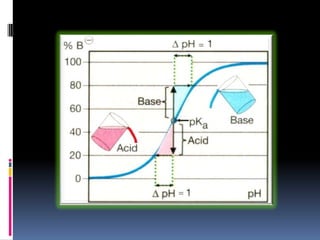
El documento describe las propiedades de ácidos y bases débiles y fuertes, y los cálculos para determinar el pH a lo largo de una titulación ácido-base. Explica que el pH depende de la concentración del ácido fuerte original al comienzo y cambia poco hasta el punto de equivalencia, donde aumenta drásticamente debido a la formación de la sal y la reacción del anión con el agua. También recomienda indicadores apropiados para la titulación con una zona de viraje entre pH 4-9.



![ Formulas Necesarias:
pH = -log[H+] y [H+]= √Ka[AD]
Ka = 10-pKa
Entonces: pH= ½ (pKa – log[AD])](https://image.slidesharecdn.com/acidodebilbasefuerte-copia-140203234135-phpapp02/85/Acido-debil-base-fuerte-6-320.jpg)

![ Formulas Necesarias:
eAds/r = eiAD – eaOH(VN)IA/D – (VN)aOH[AD]s/r
[H+]= NAds/r = -------------------------= Ka --------VT
[C]
eaOH- (VN)BF
[C]= --------= -----------VT
VT
[C]
pH = pKa + log(-----------)
[AD]s/r](https://image.slidesharecdn.com/acidodebilbasefuerte-copia-140203234135-phpapp02/85/Acido-debil-base-fuerte-8-320.jpg)


