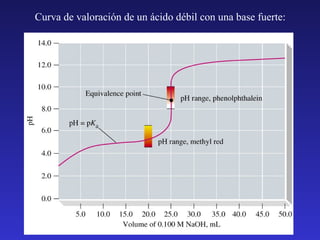
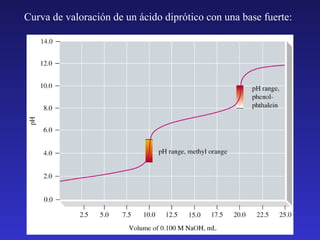
El documento resume los principales temas relacionados con los equilibrios ácido-base. Introduce las definiciones de ácido y base según Arrhenius, Brønsted-Lowry y Lewis. Explica la autoionización del agua y la escala de pH. Describe cómo se miden la fuerza de ácidos y bases a través de las constantes de ionización y disociación. Presenta el método general para calcular las concentraciones de especies en equilibrios de ionización. Además, cubre temas como la hidrólisis, disol




![1903
Tercer premio Nobel
de Química
“En reconocimiento a los extraodinarios servicios que ha
prestado al avance de la química mediante su teoría
electrolítica de la disociación”.
[http://www.nobel.se/chemistry/laureates/1903/index.html]
Svante Arrhenius
(1859-1927)
Limitaciones:
* Sustancias con propiedades básicas que no contienen
iones hidroxilo (p.ej.: NH3 líquido)
* Se limita a disoluciones acuosas.
Se requiere una perspectiva más general](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-6-320.jpg)




![2
LA AUTOIONIZACIÓN DEL AGUA.
ESCALA DE pH.
Equilibrio de autoionización del agua
H2O (l) + H2O (l) ↔ H3O+ (aq) + OH- (aq)
Producto iónico del agua
A 25ºC, Kw = 10-14
pH = − log [H3O+]
pOH = − log [OH-]
Kw = [H3O+][OH-]
[Tomando logaritmos y cambiando el signo]
− log 10-14 = − log [H3O+] − log [OH-]
14 = pH + pOH](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-11-320.jpg)
![Agua pura: [H3O+] = [OH-] ; [H3O+] = 10-7 ⇒ pH = 7
[OH-] = 10-7 ⇒ pOH = 7
DISOLUCIÓN
NEUTRA
DISOLUCIÓN
ÁCIDA
DISOLUCIÓN
BÁSICA
[H3O+] = [OH-]
pH = 7
[H3O+] > [OH-]
pH < 7
[H3O+] < [OH-]
pH > 7
ácida
7
básica
pH](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-12-320.jpg)
![3
FUERZA DE ÁCIDOS Y BASES.
CONSTANTES DE IONIZACIÓN.
Fuerza de un ácido o base: mayor o menor tendencia a transferir
o aceptar un protón.
Medida cuantitativa: constante de equilibrio de su reacción con agua.
HA(aq) + H2O (l) ↔ H3O+ (aq) + A- (aq)
[A − ][H 3O + ]
Ka =
[HA]
Constante de acidez
(de disociación, de ionización)
Mayor fuerza de un ácido: mayor será Ka (menor pKa)
Caso extremo: ácido fuerte (p.ej. HCl, HNO3, HClO4, ...)
se encuentra totalmente disociado
(Ka >> 1, Ka → ∞)](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-13-320.jpg)
![Análogamente con las bases:
B (aq) + H2O (l) ↔ BH+ (aq) + OH- (aq)
[BH + ][OH − ]
Kb =
[B]
Constante de basicidad
Mayor fuerza de una base: mayor será Kb (menor pKb)
Caso extremo: base fuerte (p.ej. NaOH, KOH, ...)
se encuentra totalmente disociada (Kb >> 1, Kb → ∞)
En el caso de un par ácido-base conjugado, Ka y Kb están relacionadas
B (aq) + H2O (l) ↔ BH+ (aq) + OH- (aq)
[BH + ][OH − ] [H 3O + ] K w
Kb =
⋅
=
+
[B]
[H 3O ] K a
Kw = K a Kb](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-14-320.jpg)

![P.ej.: equilibrio de ionización de un ácido débil HA en agua
HA(aq) + H2O (l) ↔ H3O+ (aq) + A- (aq)
1. Expresiones de las constantes de equilibrio
Equilibrios presentes
HA(aq) + H2O (l) ↔ H3O+ (aq) + A- (aq)
2 H2O (l) ↔ H3O+ (aq) + OH- (aq)
[A − ][H 3O + ]
Ka =
[HA]
2. Balance de materia:
Kw = [H3O+][OH-]
[HA]o + [A-]o = [HA] + [A-]
3. Balance de cargas (condición de electroneutralidad)
[H3O+] = [A-] + [OH-]
4. Resolver el sistema: 4 ecuaciones con 4 incógnitas](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-16-320.jpg)

![5.1. Sales procedentes de ácido fuerte y base fuerte
[p.ej.: NaCl, KCl, NaNO3]
Procede de un ácido fuerte (HCl).
No se hidroliza
NaCl (s)
H2O
Na+ (aq) + Cl- (aq)
Procede de una base fuerte (NaOH).
No se hidroliza
Disolución neutra](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-18-320.jpg)
![5.2. Sales procedentes de ácido fuerte y base débil
[p.ej.: NH4Cl]
NH4Cl (s)
H2O
Procede de un ácido fuerte (HCl).
No se hidroliza
NH4+ (aq) + Cl- (aq)
Procede de una base débil (NH3). Se hidroliza
NH4+ (aq) + H2O (l) ↔ NH3 (aq) + H3O+ (aq)
Disolución ácida
[NH 3 ][H 3O + ]
Kw
+
Kh =
= K a ( NH 4 ) =
+
[NH 4 ]
K b ( NH 3 )](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-19-320.jpg)
![5.3. Sales procedentes de ácido débil y base fuerte
[p.ej.: CH3COONa]
CH3COONa (s)
H2O
Procede de una base fuerte (NaOH).
No se hidroliza
CH3COO- (aq) + Na+ (aq)
Procede de un ácido débil (CH3COOH). Se hidroliza
CH3COO- (aq) + H2O (l) ↔ CH3COOH (aq) + OH- (aq)
Disolución básica
[CH 3COOH][OH − ]
Kw
Kh =
= K b (CH 3COO − ) =
[CH 3COO − ]
K a (CH 3COOH )](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-20-320.jpg)
![5.4. Sales procedentes de ácido débil y base débil
[p.ej.: NH4CN]
Procede de un ácido débil (HCN). Se hidroliza
NH4CN (s)
H2O
NH4+ (aq) + CN- (aq)
Procede de una base débil (NH3). Se hidroliza
Si Kh (catión) > Kh (anión) ⇒ Disolución ácida
Si Kh (catión) < Kh (anión) ⇒ Disolución básica
Si Kh (catión) = Kh (anión) ⇒ Disolución neutra
[Para el NH4CN: disolución básica]](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-21-320.jpg)

![Mecanismo de acción:
HA (aq) + H2O (l) ↔ H3O+ (aq) + A- (aq)
[A − ][H 3O + ]
[HA]
[A − ]
Ka =
; [H 3O + ] = K a − ; pH = pK a + log
[HA]
[A ]
[HA]
Si al equilibrio le añado, p.ej., un ácido, se desplazará a la izquierda,
disminuirá el cociente [A-]/[HA] y el pH bajará.
Pero si la cantidad añadida es pequeña comparada con las
cantidades (grandes) que hay de A- y HA, el cociente cambiará muy
poco y el pH apenas se modificará.
P.ej.:
* si añado 0.001 moles de HCl a un 1 L de agua, el pH pasa de 7 a 3.
* si añado 0.001 moles de HCl a un 1 L de disolución que contiene
0.7 moles de acético y 0.6 moles de acetato sódico, el pH pasa
de 4.688 a 4.686.](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-23-320.jpg)
![¿Cómo calcular el pH de una disolución tampón?
Con el tratamiento exacto visto en el apartado 4.
¿Cómo estimar aproximadamente el pH de una disolución tampón?
pH = pK a + log
[A − ]eq
[HA]eq
pH = pK a + log
[base]eq
[ácido]eq
Exacta
Dado que las concentraciones iniciales de ácido y de su base conjugada
son grandes, se puede suponer que las cantidades que desaparecerán y
que aparecerán mientras se va alcanzando el equilibrio serán pequeñas,
comparadas con las iniciales.
Por tanto, en la fórmula anterior las concentraciones en el equilibrio
se pueden aproximar por las concentraciones iniciales.
pH = pK a + log
[base]o
[ácido]o
Ecuación de
Henderson-Hasselbach
Aproximada](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-24-320.jpg)
![Características importantes de una disolución amortiguadora:
* Su pH ⇒ depende de Ka y de las concentraciones
* Su capacidad amortiguadora
Capacidad amortiguadora: Cantidad de ácido o base que se puede
agregar a un tampón antes de que el pH comience a cambiar de
modo apreciable.
¿De qué depende?
* Del número de moles de ácido y base
(deben ser altos para que la capacidad también lo sea)
* Del cociente [base]/[ácido].
(para que la capacidad sea alta, ha de ser próximo a 1.
Si es < 0.1 ó > 10, no será muy eficiente.
Mayor eficiencia: cuando pH = pKa)](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-25-320.jpg)
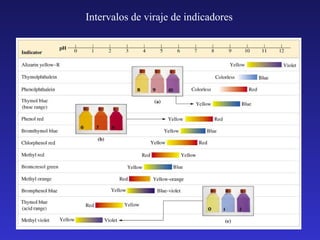
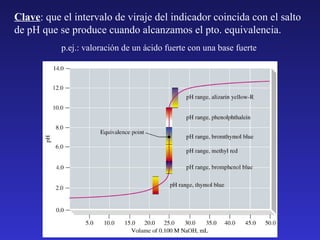
![7
INDICADORES.
Indicadores: Ácidos o bases débiles cuyas formas ácido/base
conjugadas presentan colores diferentes.
HInd (aq) + H2O (l) ↔ H3O+ (aq) + Ind- (aq)
Color A
Color B
[Ind − ][H 3O + ]
K a (HInd) =
[HInd]
Cuando a una disolución le añadimos un indicador,
estarán presentes las dos especies HInd e Ind-.](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-26-320.jpg)
![¿Qué color veré?
• Si [HInd]/[Ind-] ≥ 10 ⇒ Color A (predomina forma ácida)
• Si [HInd]/[Ind-] ≤ 0.1 ⇒ Color B (predomina forma básica)
• Si 0.1< [HInd]/[Ind-]< 10 ⇒ Color mezcla de A y B
El cociente depende de la Ka y del pH:
K Ind
[Ind − ][H 3O + ]
=
[HInd]
[H 3O + ] = K Ind ⋅
[HInd]
[Ind − ]
• Si [HInd]/[Ind-] ≥ 10 ⇒ [Η3Ο+] ≥ 10 KInd ⇒ pH ≤ pKInd –1
Color A (predomina forma ácida)
• Si [HInd]/[Ind-] ≤ 0.1 ⇒ [Η3Ο+] ≤ 0.1 KInd ⇒ pH ≥ pKInd +1
Color B (predomina forma básica)
• Si 0.1< [HInd]/[Ind-]< 10 ⇒ pKInd –1 < pH < pKInd +1 Mezcla A y B
Intervalo de viraje (2 unidades de pH)](https://image.slidesharecdn.com/teoriaacidobase-131211084545-phpapp01/85/Teoria-acido-base-27-320.jpg)