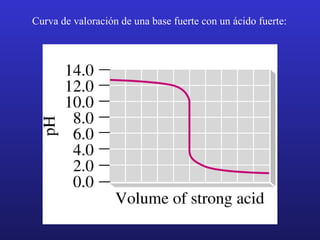
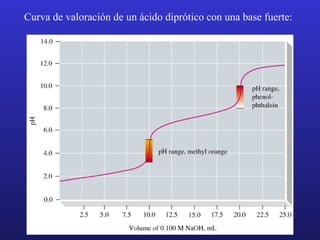
El documento proporciona un resumen de los principales temas relacionados con las reacciones ácido-base, incluyendo definiciones de ácidos y bases según Arrhenius, Brønsted-Lowry y Lewis, la autoionización del agua y la escala de pH, la fuerza de ácidos y bases y sus constantes de ionización, el tratamiento de los equilibrios de ionización, la hidrólisis de sales, las disoluciones amortiguadoras y los indicadores.





![Svante August Arrhenius (1859-1927) [ http:// nobelprize.org /chemistry/laureates/190 3 /index.html ] “ En reconocimiento a los extraodinarios servicios que ha prestado al avance de la química mediante su teoría electrolítica de la disociación”. 1903 Tercer premio Nobel de Química Limitaciones: * Sustancias con propiedades básicas que no contienen iones hidroxilo (p.ej.: NH 3 líquido) * Se limita a disoluciones acuosas. Se requiere una perspectiva más general](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-6-320.jpg)




![LA AUTOIONIZACIÓN DEL AGUA. ESCALA DE pH. 2 pH = log [H 3 O + ] pOH = log [OH ] Equilibrio de autoionización del agua H 2 O (l) + H 2 O (l) H 3 O + (aq) + OH (aq) log 10 -14 = log [H 3 O + ] log [OH ] 14 = pH + pOH K w = [H 3 O + ][OH ] Producto iónico del agua A 25ºC, K w = 10 -14 [Tomando logaritmos y cambiando el signo]](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-11-320.jpg)
![Agua pura: [H 3 O + ] = [OH ] ; [H 3 O + ] = 10 -7 pH = 7 [OH ] = 10 -7 pOH = 7 DISOLUCIÓN NEUTRA [H 3 O + ] = [OH ] pH = 7 DISOLUCIÓN ÁCIDA [H 3 O + ] > [OH ] pH < 7 DISOLUCIÓN BÁSICA [H 3 O + ] < [OH ] pH > 7 pH 7 ácida básica](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-12-320.jpg)



![1. Expresiones de las constantes de equilibrio 2. Balance de materia: [HA] o + [A ] o = [HA] + [A ] 3. Balance de cargas (condición de electroneutralidad) [H 3 O + ] = [A ] + [OH ] 4. Resolver el sistema: 4 ecuaciones con 4 incógnitas HA(aq) + H 2 O (l) H 3 O + (aq) + A (aq) P.ej.: equilibrio de ionización de un ácido débil HA en agua Equilibrios presentes HA(aq) + H 2 O (l) H 3 O + (aq) + A (aq) 2 H 2 O (l) H 3 O + (aq) + OH (aq) K w = [H 3 O + ][OH ]](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-16-320.jpg)

![5.1. Sales procedentes de ácido fuerte y base fuerte [p.ej.: NaCl, KCl, NaNO 3 ] NaCl (s) H 2 O Na + (aq) + Cl (aq) Procede de una base fuerte (NaOH). No se hidroliza Procede de un ácido fuerte (HCl). No se hidroliza Disolución neutra](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-18-320.jpg)
![5.2. Sales procedentes de ácido fuerte y base débil [p.ej.: NH 4 Cl] Disolución ácida NH 4 Cl (s) H 2 O NH 4 + (aq) + Cl (aq) Procede de una base débil (NH 3 ). Se hidroliza Procede de un ácido fuerte (HCl). No se hidroliza NH 4 + (aq) + H 2 O (l) NH 3 (aq) + H 3 O + (aq)](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-19-320.jpg)
![5.3. Sales procedentes de ácido débil y base fuerte [p.ej.: CH 3 COONa] Disolución básica CH 3 COONa (s) H 2 O CH 3 COO (aq) + Na + (aq) Procede de un ácido débil (CH 3 COOH). Se hidroliza Procede de una base fuerte (NaOH). No se hidroliza CH 3 COO (aq) + H 2 O (l) CH 3 COOH (aq) + OH (aq)](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-20-320.jpg)
![5.4. Sales procedentes de ácido débil y base débil [p.ej.: NH 4 CN] Si K h (catión) > K h (anión) Disolución ácida Si K h (catión) < K h (anión) Disolución básica Si K h (catión) = K h (anión) Disolución neutra [Para el NH 4 CN: disolución básica] NH 4 CN (s) H 2 O NH 4 + (aq) + CN (aq) Procede de una base débil (NH 3 ). Se hidroliza Procede de un ácido débil (HCN). Se hidroliza](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-21-320.jpg)

![Mecanismo de acción: Si al equilibrio le añado, p.ej., un ácido, se desplazará a la izquierda, disminuirá el cociente [A ]/[HA] y el pH bajará. Pero si la cantidad añadida es pequeña comparada con las cantidades (grandes) que hay de A y HA, el cociente cambiará muy poco y el pH apenas se modificará. P.ej.: * si añado 0.001 moles de HCl a un 1 L de agua, el pH pasa de 7 a 3. * si añado 0.001 moles de HCl a un 1 L de disolución que contiene 0.7 moles de acético y 0.6 moles de acetato sódico, el pH pasa de 4.688 a 4.686. HA (aq) + H 2 O (l) H 3 O + (aq) + A (aq)](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-23-320.jpg)


![Características importantes de una disolución amortiguadora: * Su pH depende de K a y de las concentraciones * Su capacidad amortiguadora Capacidad amortiguadora : Cantidad de ácido o base que se puede agregar a un tampón antes de que el pH comience a cambiar de modo apreciable. ¿De qué depende? * Del número de moles de ácido y base (deben ser altos para que la capacidad también lo sea) * Del cociente [base]/[ácido]. (para que la capacidad sea alta, ha de ser próximo a 1. Si es < 0.1 ó > 10, no será muy eficiente. Mayor eficiencia: cuando pH = pK a )](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-26-320.jpg)

![¿Qué color veré? Si [HInd]/[Ind ] 10 Color A (predomina forma ácida) Si [HInd]/[Ind ] 0.1 Color B (predomina forma básica) Si 0.1 [HInd]/[Ind ] Color mezcla de A y B El cociente depende de la K a y del pH : Si [HInd]/[Ind ] 10 10 K Ind pH pK Ind –1 Color A (predomina forma ácida) Si [HInd]/[Ind ] 0.1 0.1 K Ind pH pK Ind +1 Color B (predomina forma básica) Si 0.1 [HInd]/[Ind ] pK Ind –1 < pH < pK Ind +1 Mezcla A y B Intervalo de viraje (2 unidades de pH)](https://image.slidesharecdn.com/acidobase-6278/85/acido-base-28-320.jpg)