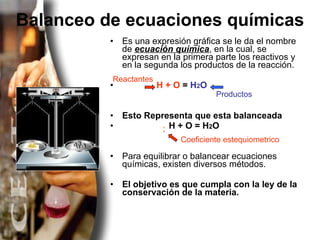
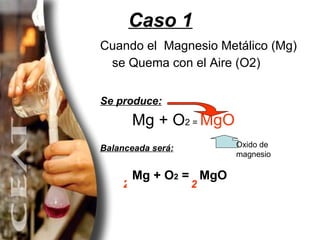
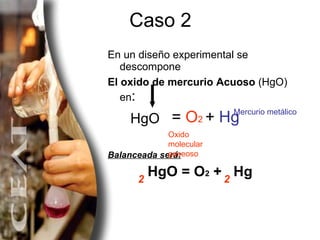
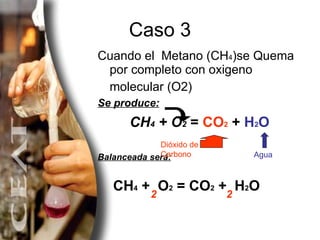
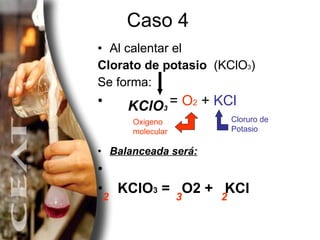
El documento explica diferentes métodos para balancear ecuaciones químicas, incluyendo el método de tanteo y el método algebraico. Presenta varios ejemplos de ecuaciones químicas balanceadas usando estos métodos, como la combustión del metano y la descomposición del clorato de potasio.