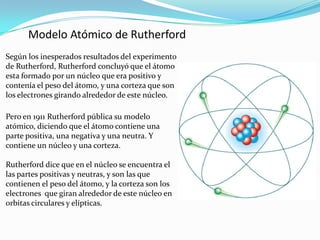
El documento describe la historia del modelo atómico, comenzando con las ideas de Leucipo y Demócrito sobre átomos indivisibles. Luego describe los modelos atómicos de Dalton, Thomson, Rutherford y Bohr, los cuales surgieron con bases científicas y ayudaron a explicar propiedades atómicas. El modelo de Bohr propuso que los electrones solo pueden existir en órbitas discretas alrededor del núcleo con energías cuantizadas.