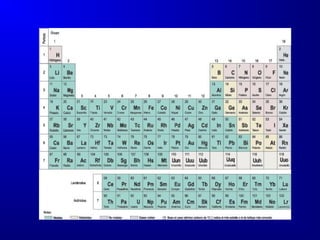
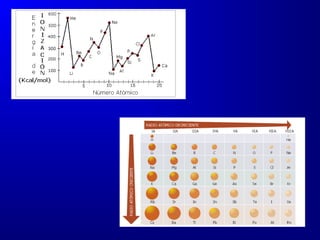
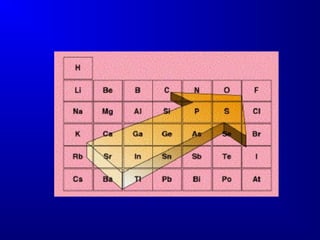
El documento describe la historia y desarrollo de la estructura atómica, incluyendo las teorías de Dalton, Bohr, Schrödinger y Heisenberg. Explica que los átomos están compuestos de electrones, protones y neutrones, y que la configuración de los electrones en orbitales atómicos determina las propiedades periódicas de los elementos. También introduce conceptos clave como los números atómicos, masa atómica, isótopos, y la tabla periódica de los elementos de Mendeleev.