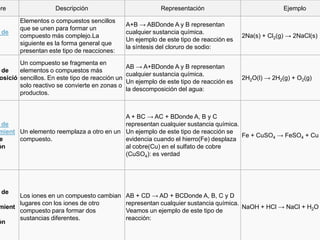
Este documento describe los conceptos fundamentales de las reacciones químicas, incluyendo las definiciones de fenómeno químico y reacción, los tipos comunes de reacciones como combustión y precipitación, y factores como el grado de avance, afinidad química y rendimiento. También cubre brevemente las reacciones de la química orgánica y los enlaces a temas relacionados.