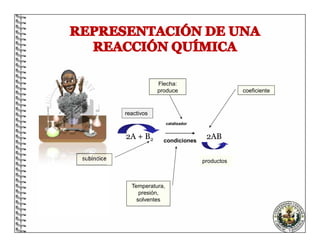
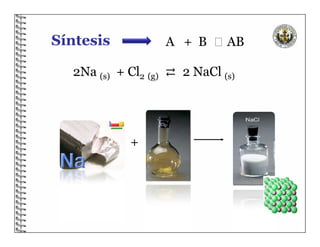
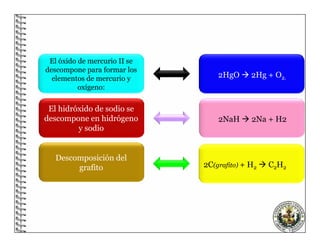
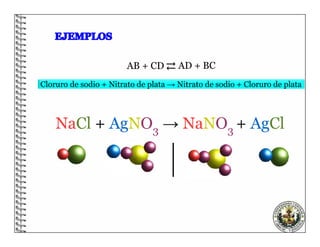
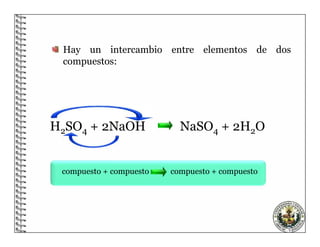
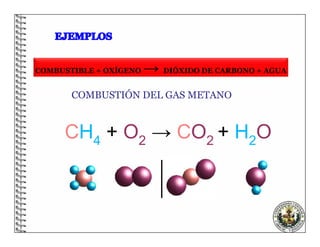
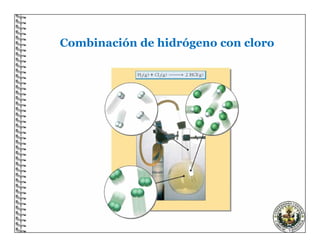
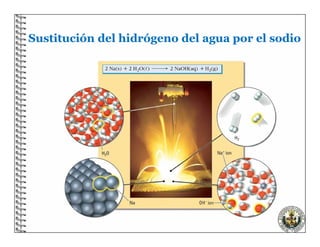
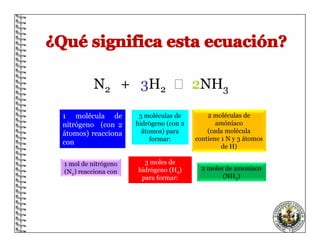
El documento describe los conceptos básicos de las reacciones químicas, incluyendo que una reacción química representa un cambio en la composición de la materia y se puede representar mediante una ecuación química. También explica que para equilibrar una ecuación química, los métodos deben cumplir con la ley de conservación de la materia.