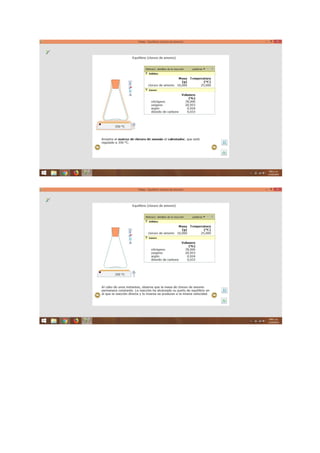
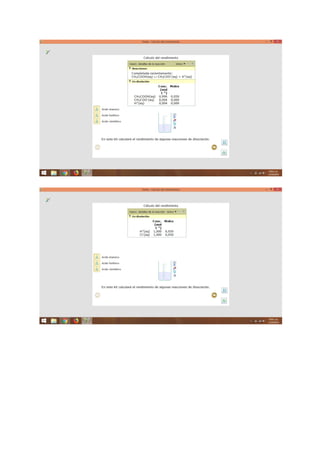
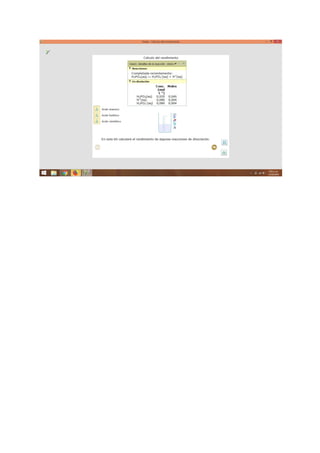
El documento presenta información sobre temas químicos como reacciones en equilibrio, compuestos y reacciones químicas, equilibrio y temperatura, y moles y masas. Explica conceptos como equilibrio químico, factores que afectan la velocidad de reacción, ejemplos de equilibrio químico, y características del equilibrio químico. También define compuestos químicos, masa molar, y masa molecular.