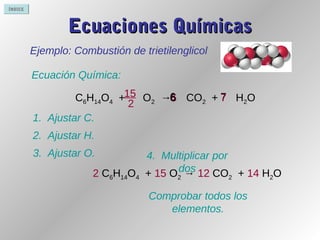
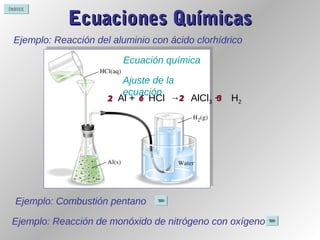
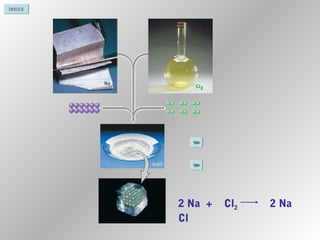
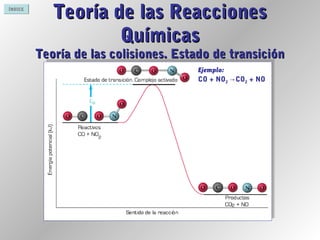
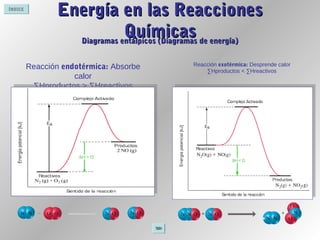
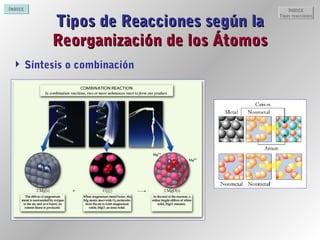
Este documento proporciona información sobre reacciones químicas. Explica la diferencia entre cambios físicos y químicos, define una reacción química y describe cómo se representan mediante ecuaciones químicas. También cubre conceptos como la teoría de colisiones, el estado de transición, los factores que afectan la velocidad de una reacción y la energía involucrada en las reacciones químicas.