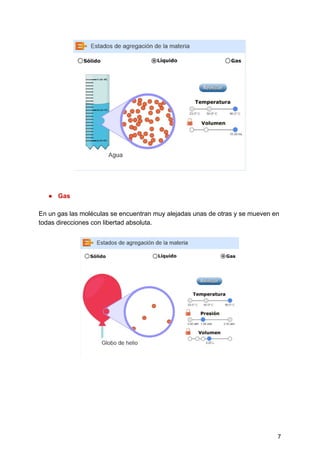
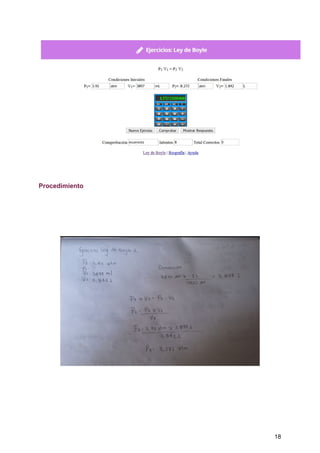
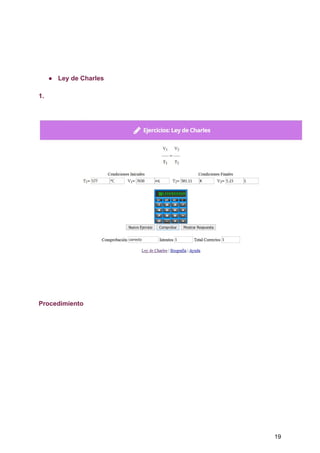
Este documento presenta un informe de laboratorio sobre gases realizado por Laura Alejandra Gutierrez Manchola para su profesora Diana Fernanda Jaramillo. El informe incluye una introducción sobre la importancia de los gases, objetivos, procedimiento, marco teórico sobre estados de agregación, temperatura, presión, volumen y cantidad de gas. También explica las leyes de Avogadro, Boyle, Charles, Gay y gases ideales a través de ecuaciones y ejemplos. Por último, presenta ejercicios resueltos aplicando dichas leyes.