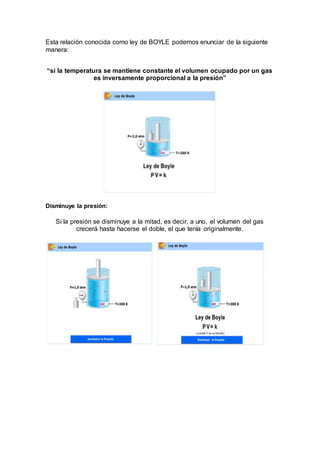
Este documento presenta información sobre conceptos químicos fundamentales como los estados de la materia, temperatura, presión, volumen y cantidad de gas. Explica las leyes de Boyle, Charles y los gases ideales, y describe experimentos de laboratorio para ilustrar estas leyes, como la sala de Boyle y la sala de Charles. El objetivo es que los estudiantes comprendan y apliquen estas leyes a través de ejercicios y repasar los temas vistos en clase de química.