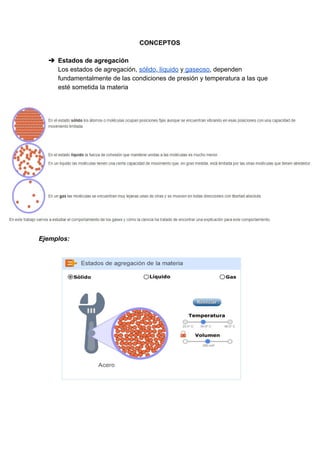
El documento presenta un laboratorio de química sobre el estudio de los gases, sus leyes y conceptos fundamentales como presión, temperatura, volumen y cantidad de gases. Se explican las leyes de Boyle y Charles, además de realizar ejercicios prácticos y conclusiones sobre el comportamiento de los gases en relación a las variables de estado. El objetivo es fomentar el entendimiento experimental de estas leyes para su aplicación en contextos ambientales y de salud.