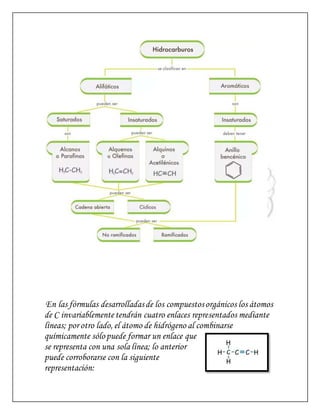
Este documento presenta información sobre hidrocarburos y la tabla periódica. Explica que los hidrocarburos son compuestos formados por enlaces de átomos de carbono que pueden formar cadenas o anillos. Luego describe los elementos que conforman los grupos IVA, VA, VIA y VIIA de la tabla periódica, incluyendo sus propiedades generales y ejemplos específicos como el carbono, oxígeno, flúor y otros.




![-Silicio. –Estaño.
-Plomo. –Flerovio.
CARBONO
INFORMACIÓN GENERAL
Nombre, símbolo, número Carbono, C, 6
Serie química No metales
Grupo, período, bloque 14, 2, p
Masa atómica 12,0111 u
Configuración electrónica [He]2s22p2](https://image.slidesharecdn.com/loshidrocarburosmodulo-170215024308/85/Los-hidrocarburos-modulo-6-320.jpg)

![INFORMACIÓN GENERAL
Nombre,símbolo,número
Silicio, Si,
14
Serie química Metaloides
Grupo, período, bloque 14, 3, p
Masa atómica 28,085 u
Configuración
electrónica
[Ne]3s2 3p2
El silicio formaparte de los elementos denominados
metaloideso semimetales, tienepropiedades intermedias entre
metales y no metales.
Su conductividad eléctrica es semiconductora.
CARACTERISTICAS
-El estado del silicio es su forma natural es sólido (no
magnético).
- El punto de fusión del silicio es de 1687 grados Kelvin o de
1414,85 grados Celsius.
- El silicio tiene un total de 14 electrones cuya distribuciónes
la siguiente:En la primeracapa tiene 2 electrones, en la](https://image.slidesharecdn.com/loshidrocarburosmodulo-170215024308/85/Los-hidrocarburos-modulo-8-320.jpg)
![segunda tiene 8 electrones y en su tercera capa tiene 4
electrones.
GERMANIO
Nombre, símbolo,número
Germanio, Ge,
32
Serie química Metaloides
Grupo, período, bloque 14, 4, p
Masa atómica 72,64 u
Configuración
electrónica
[Ar]3d10 4s2 4p2
El germanio es un semimetal, de color blanco grisáceo lustroso,
quebradizo, que conserva el brillo a temperaturas ordinarias.
Presenta la mismaestructura cristalina que el dimantey resiste
a los ácidos álcalis.
Su descubrimiento sirvió para confirmarla validez de la tabla
periódica.
ESTAÑO
INFORMACIÓN GENERAL
Nombre, símbolo,número Estaño, Sn, 50](https://image.slidesharecdn.com/loshidrocarburosmodulo-170215024308/85/Los-hidrocarburos-modulo-9-320.jpg)
![Serie química
Metales del
bloque p
Grupo, período, bloque 14, 5, p
Masa atómica 118,710 u
Configuración
electrónica
[Kr]4d10 5s2 5p
El estaño se obtiene del mineral casiterita. Dicho mineral de
muele y se enriquece en dióxido de estaño por flotación, después
se tuesta y se calienta con coque en un horno de reverbero con
lo cual se obtiene el metal.
Es un metal plateado, maleable, que se oxida fácilmente, a
temperatura ambiente, cambiando de color a un gris más opaco,
y es resistentea la corrosión, se encuentra en muchas aleaciones
y se usa para recubrir otros metales protegiéndolos de la
corrosión.
FLEROVIO
INFORMACIÓN GENERAL
Nombre, símbolo,número Estaño, Sn, 50
Serie química
Metales del
bloque p](https://image.slidesharecdn.com/loshidrocarburosmodulo-170215024308/85/Los-hidrocarburos-modulo-10-320.jpg)
![Grupo, período, bloque 14, 5, p
Masa atómica 118,710 u
Configuración
electrónica
[Kr]4d10 5s2 5p
TABLA PERIÓDICA GRUPO VA:
(NITROGENOIDES)
Los elementos que componen a la familia del nitrógeno o
nitrogenoides son:
Nitrógeno (N) Fosforo (F) Arsénico(As)](https://image.slidesharecdn.com/loshidrocarburosmodulo-170215024308/85/Los-hidrocarburos-modulo-11-320.jpg)




![- Poseen la configuración electrónica s2p5:
Flúor: [He]2s2p5
Cloro: [Ne]3s2p5
Bromo: [Ar]3d104s2p5
Iodo: [Kr]4d105s2p5
- Todos los elementos del Grupo de los Halógenos poseen al
menos la valencia -1
- Se pueden combinar con los metales para
formar Halogenuros o Haluros:
Fluoruros: LiF, BF3, OF2, SF6...
Cloruros: NaCl, LiCl, CuCl2, Hg2Cl2, AgCl, FeCl3...
Bromuros: CH3Br, CsBr, SBr2, KBr, NaBr, MgBr2, CBr4,...
Yoduros: CsI, KI, NaI, NI3...
- Reaccionan fácilmente con los Hidrocarburospara dar
lugar a los Halogenuros de Alguilo:
CH3Br Bromometano
CH3-(C=O)-Cl Cloruro de etanolio
CHI3
- Los Halógenos presentan energías de ionizaciónmuy
altos](https://image.slidesharecdn.com/loshidrocarburosmodulo-170215024308/85/Los-hidrocarburos-modulo-16-320.jpg)
