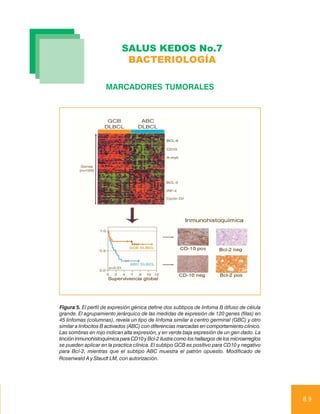
Este documento trata sobre marcadores tumorales. Explica la clasificación de marcadores tumorales en tisulares, circulantes y genéticos. Describe las aplicaciones clínicas de los marcadores tumorales como tamizaje, diagnóstico, pronóstico y seguimiento. Finalmente, analiza dos marcadores tumorales circulantes comúnmente usados: el antígeno carcinoembrionario y la gonadotropina coriónica humana.










































![SALUS KEDOS No.7
BACTERIOLOGÍA
MARCADORES TUMORALES
El nadir PSA (valor de PSA más bajo luego de la radioterapia) parece
correlacionarse con la probabilidad de permanecer libre de enfermedad.
El riesgo de recaídas declina progresivamente a medida que el nadir
decrece a menos de 1,0 ng/mL. Se han observado menos recaídas entre
pacientes con nadires menores a 0,4 ng/mL en comparación con nadires
más altos, pero aun menores a 1,0 ng/mL. En un estudio reciente, se
evaluó el impacto del nadir PSA en la recaída bioquímica y en la supervi-
vencia. Los pacientes con nadires mayores a 1,2 tuvieron un peor pro-
nóstico para falla bioquímica (p=0.001) y para supervivencia (p= 0.0001).
Un 70% de pacientes con nadires de PSA por debajo de 1,2 estaba libre
de enfermedad después de 4 años comparado con solo un 40% de pa-
cientes con nadir de PSA de 1,2 o mayor. En un modelo multivariado el
nadir de PSA alcanzado fue el predictor más significativo de superviven-
cia libre de recaída bioquímica (p<0.0001) y de supervivencia libre de
progresión (p<0.0001).
Aunque en general se acepta que la elevación del PSA es una medida
sensible de progresión no hay claridad en cuanto a que tan significativa
es una elevación. Una evaluación adecuada del estado libre de enfer-
medad requiere varias observaciones en intervalos de tiempo relativa-
mente cortos (cada 3 o 6 meses) para diferenciar una elevación consis-
tente de un error de laboratorio, o de una variación biológica normal. Una
forma de evaluar el riesgo particular asociado a elevación de PSA des-
pués de radioterapia es calcular el tiempo de duplicación del PSA (DT),
definido como log 2 x t/ [log(PSA final) -log(PSA inicial)], donde t es el
tiempo desde el nivel inicial de PSA hasta el nivel final. Un tiempo de
duplicación inferior a 12 meses y un intervalo corto desde el final del
tratamiento a la primera elevación de PSA (menor a 12 meses) son
predictores significativos e independientes de metástasis distantes. Sin
embargo, en paciente tratados con radioterapia el empleo de la cinética
de marcador es bastante controversial.
PSA post prostatectomía radical
La prostatectomía radical está indicada en tumores clínicamente locali-
zados y la eficiencia del tratamiento es evaluada a largo término. El PSA
43](https://image.slidesharecdn.com/articulomayra-110508131719-phpapp02/85/MARCADORES-TUMORALES-43-320.jpg)














































![SALUS KEDOS No.7
BACTERIOLOGÍA
MARCADORES TUMORALES
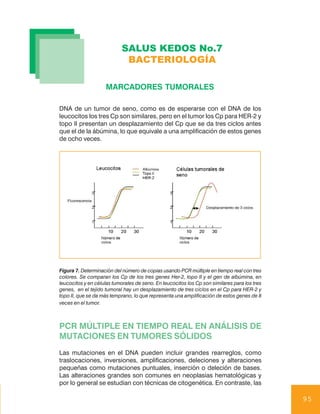
mos en un estudio reciente en el que se identificó mediante microarreglos
que el gen de la osteopontina, que codifica una glicofosfoproteína que
se une al calcio, estaba sobre expresado en cáncer de ovario y no en
controles sanos, posteriormente se encontró que las pacientes con cán-
cer de ovario presentaban concentraciones séricas elevadas de
osteopontina. La tecnología de los microarreglos tiene un gran potencial
para identificar biomarcadores en cáncer que luego serán validados con
metodologías más convencionales.
PCR CUANTITATIVA EN TIEMPO REAL
En paralelo con el desarrollo de la tecnología de los microarreglos, se
han dado los avances en PCR cuantitativa en tiempo real, este es un
método homogéneo que incluye amplificación y análisis sin necesidad
de geles, radioactividad o manipulación de las muestras. Existen varias
plataformas disponibles comercialmente que incorporan ciclados térmi-
cos y adquisición de fluorescencia. La fluorescencia de los colorantes
unidos a las sondas de DNA es monitoreada cada ciclo durante la PCR.
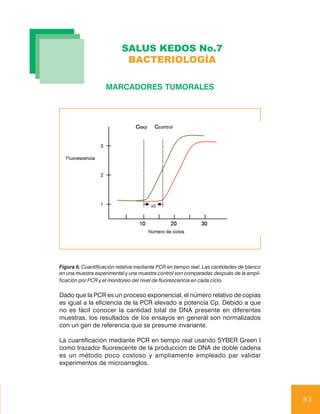
En un cierto punto durante el ciclado se acumula suficiente producto para
incrementar la fluorescencia por encima del ruido de fondo. El punto don-
de la fluorescencia se eleva por encima del background es cuantificado
como el máximo de la segunda derivada de la curva [punto de cruce
(Cp)] y se correlaciona con la cantidad de copias al inicio de la reacción
de PCR. A mayor número de copias templete iniciales, más rápido apa-
rece la fluorescencia y menor es el Cp. El número relativo de copias entre
dos muestras (experimental y control) puede determinarse por la dife-
rencia en sus valores Cp. Ver figura 6.
92](https://image.slidesharecdn.com/articulomayra-110508131719-phpapp02/85/MARCADORES-TUMORALES-92-320.jpg)