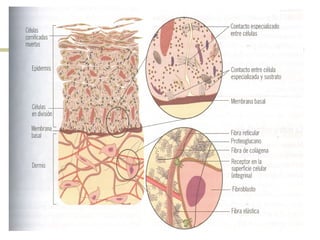
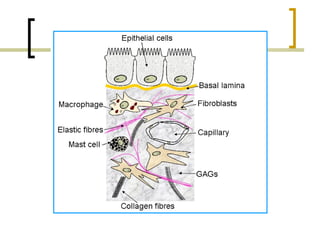
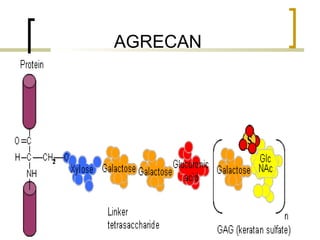
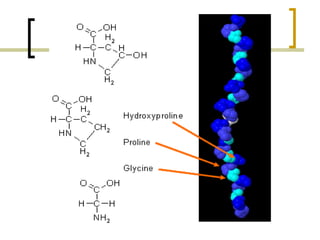
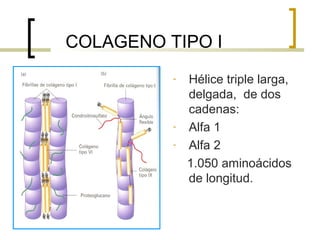
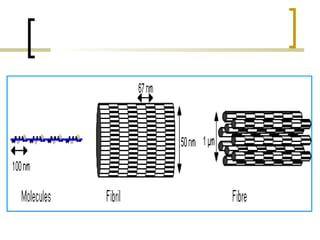
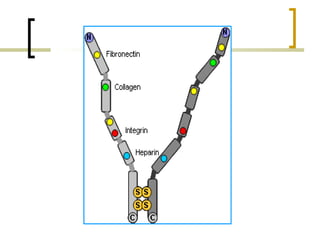
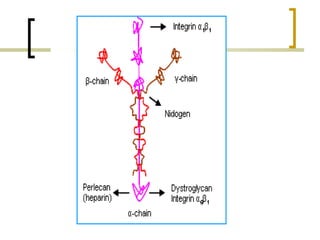
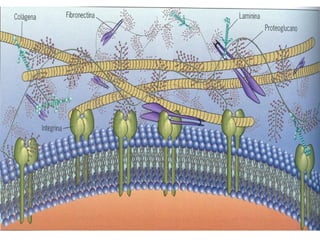
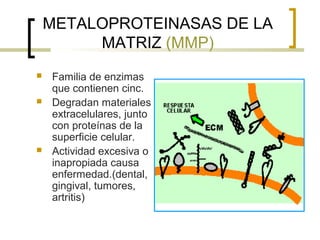
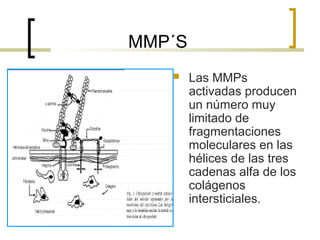
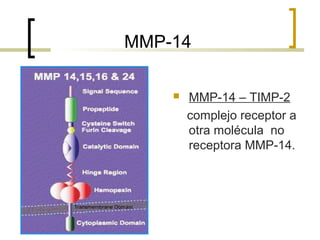
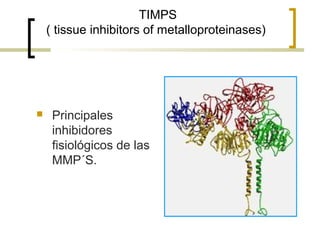
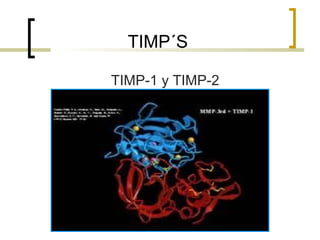
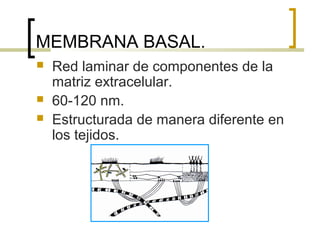
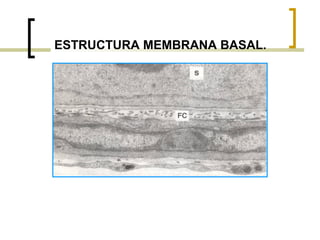
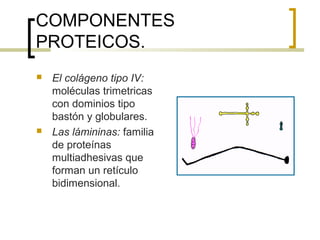
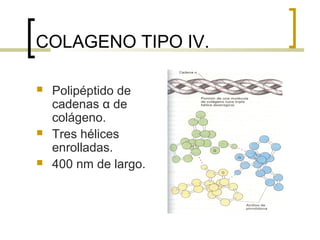
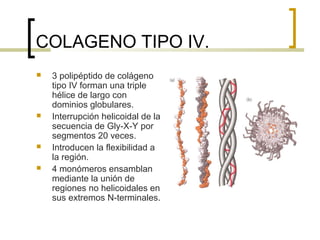
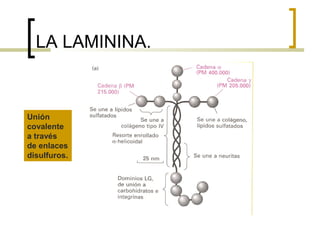
Este documento describe los principales componentes de la matriz extracelular y la membrana basal. Resume los tipos de glicosaminoglicano, proteoglucanos como el agrecano, los diferentes tipos de colágeno como el colágeno tipo I, fibronectina, laminina, metaloproteinasas de la matriz y sus inhibidores TIMPs. También describe la estructura de la membrana basal incluyendo la lamina lucida, densa y reticular, así como sus principales componentes proteicos como el colágeno tipo IV, lamininas y proteoglucanos