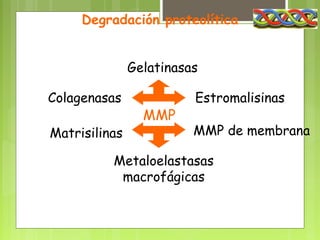
El colágeno es una proteína fibrosa estructural que se encuentra en todos los tejidos y sirve de soporte. Está compuesto principalmente por los aminoácidos glicina, prolina e hidroxiprolina. Se sintetiza en forma de fibrillas en el exterior de las células y se ensambla en fibras que confieren resistencia a los tejidos. La deficiencia de vitamina C impide la formación correcta del colágeno, lo que puede causar escorbuto u osteogénesis imperfecta.