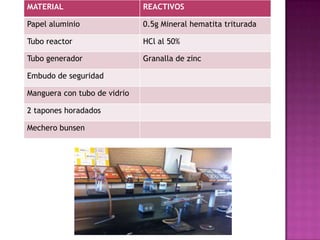
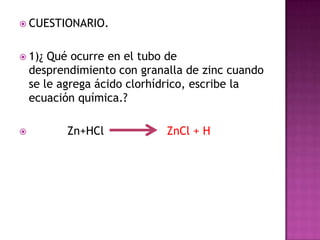
El documento describe un experimento para obtener hierro metálico a partir de la reducción del óxido de hierro (hematita) con hidrógeno gaseoso. Se coloca la hematita en un tubo de reacción y se hace pasar hidrógeno producido por la reacción de zinc y ácido clorhídrico. La hematita cambia de color más oscuro cuando se calienta, indicando la reducción parcial del óxido a hierro metálico y agua.










![ PROCEDIMIENTO
Se introdujeron 2 placas 1 de cobre [se coloco en el circuito
negativo (Cu)] y 1 de Zinc [se coloco en el circuito positivo
(Zn)] en una solución de latón durante un tiempo aproximado
de 5 a 10 minutos conduciendo electricidad de una fuente de
poder de 20 volts](https://image.slidesharecdn.com/metales-121119184556-phpapp01/85/Metales-13-320.jpg)

