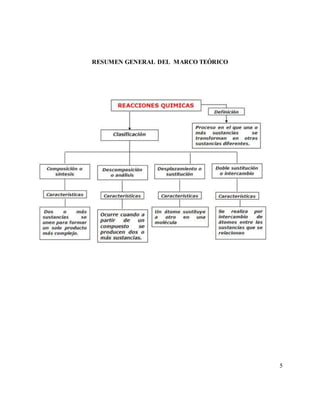
Este informe de laboratorio describe varias reacciones químicas realizadas. Se observó que la mezcla de óxido de calcio y agua formó una base, mientras que la mezcla de carbonato de calcio y ácido formó dióxido de carbono. También se observó que la mezcla de zinc y ácido clorhídrico produjo hidrógeno gaseoso. Finalmente, el informe concluye que las reacciones químicas son importantes en la vida y forman las sustancias necesarias para los seres vivos.