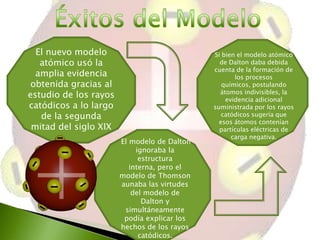
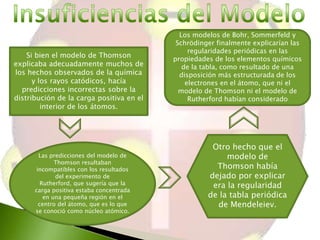
El documento describe el modelo atómico de J.J. Thomson, en el cual propuso que los átomos estaban compuestos por electrones distribuidos uniformemente dentro de una esfera de carga positiva, similar a un budín de pasas. Este modelo fue el primero en proponer una estructura interna del átomo y ayudó a explicar los resultados de los experimentos con rayos catódicos de la época. Sin embargo, no podía explicar completamente la distribución de la carga eléctrica en el átomo.