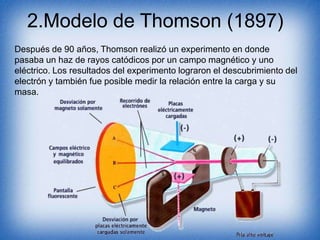
El documento detalla la evolución de los modelos atómicos desde los conceptos de Leucipo y Demócrito sobre la indivisibilidad de la materia, pasando por el modelo esférico de Dalton, el descubrimiento del electrón por Thomson, hasta el modelo nuclear propuesto por Rutherford que establece la existencia de un núcleo positivo y electrones en órbitas. Cada modelo se basa en experimentos clave y propone características esenciales de los átomos y sus interacciones. Finalmente, se menciona la importancia de estos descubrimientos en la comprensión de la materia.