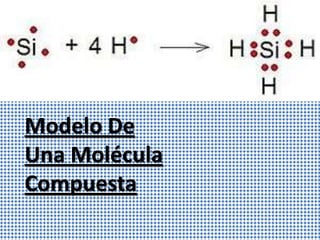
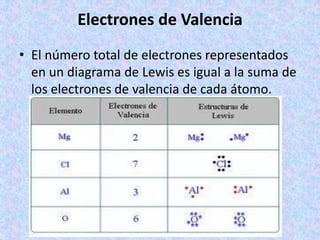
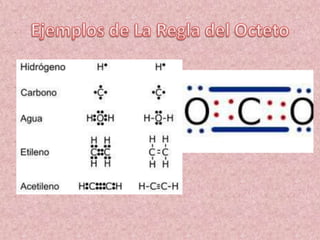
El documento explica la estructura de Lewis para representar moléculas. Describe cómo los átomos se unen entre sí para completar su capa de valencia con 8 electrones según la regla del octeto. Explica cómo se calcula la carga formal de un átomo y provee un ejemplo detallado de cómo dibujar la estructura de Lewis para el ión nitrito.