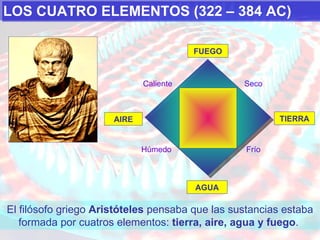
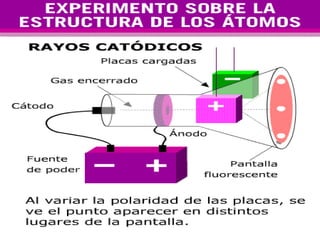
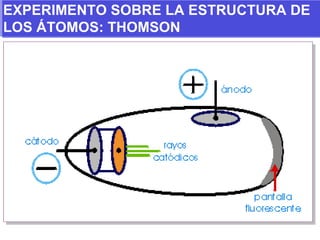
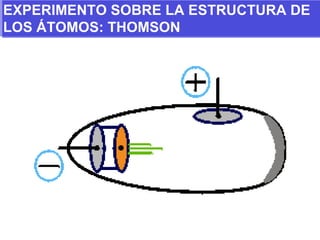
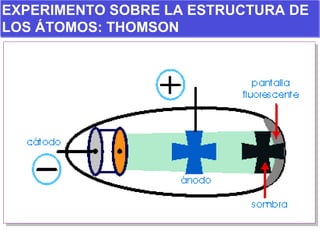
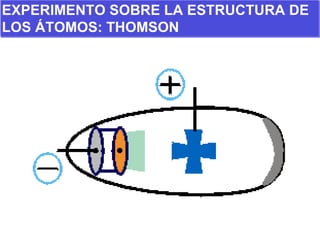
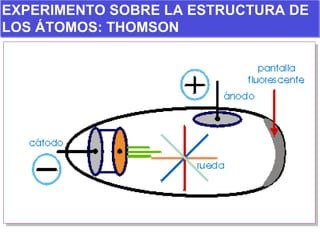
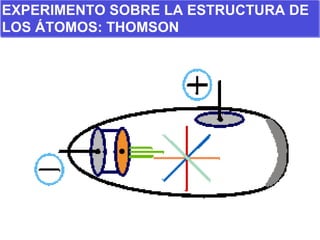
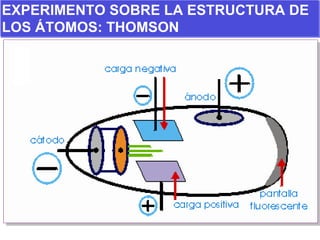
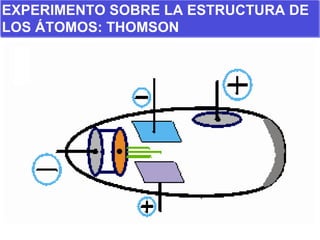
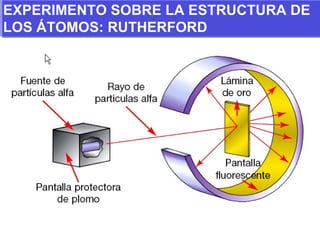
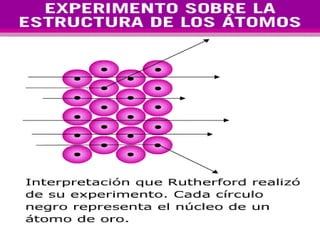
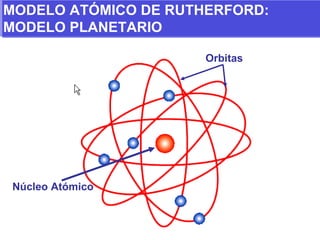
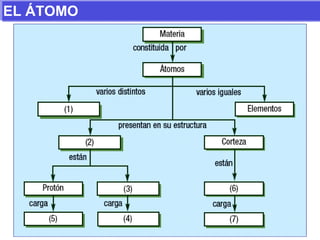
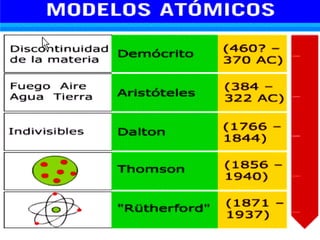
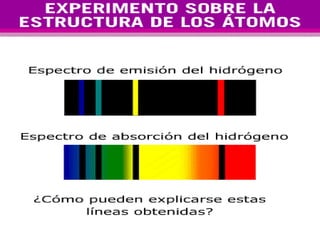
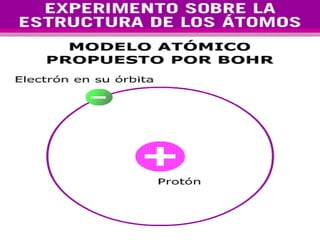
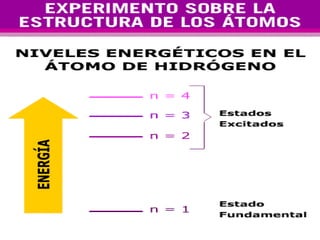
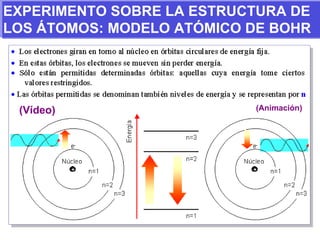
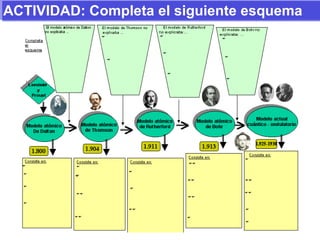
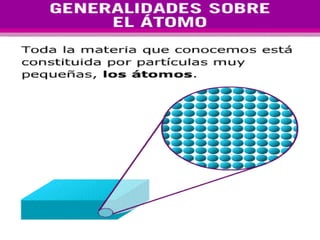
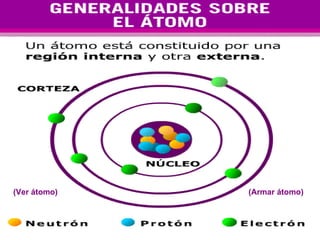
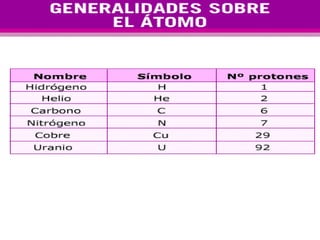
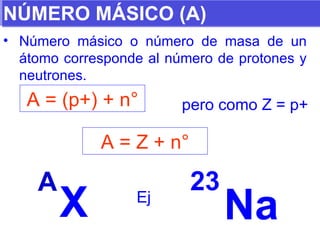
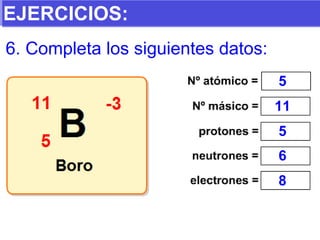
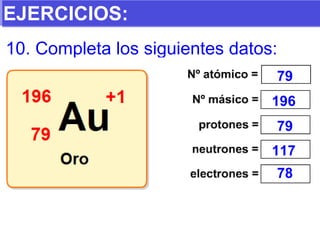
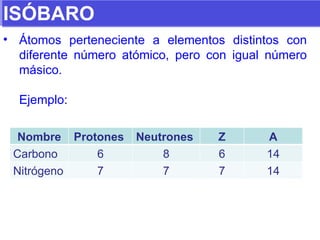
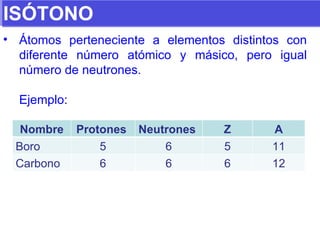
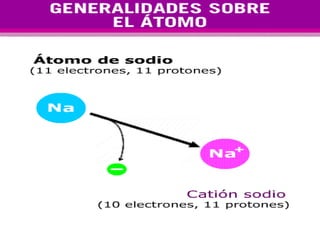
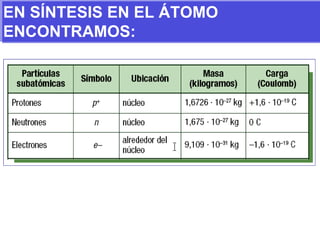
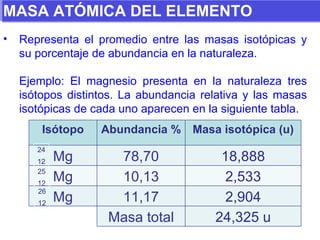
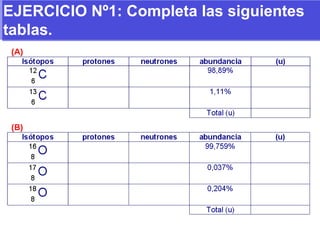
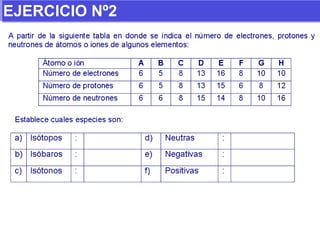
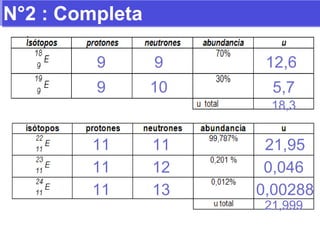
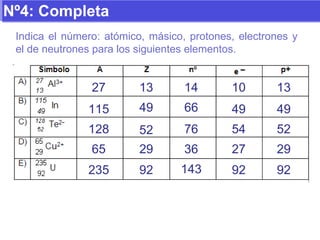
El documento presenta los modelos atómicos desde la antigüedad hasta el modelo actual. Explica el modelo de Thomson basado en los rayos catódicos, el modelo planetario de Rutherford con el núcleo central y las órbitas de electrones, y el modelo cuántico de Bohr con los estados estacionarios de los electrones. También define conceptos como número atómico, número másico, isótopos, y masa atómica. Incluye preguntas y ejercicios para comprender y aplicar estos conceptos.