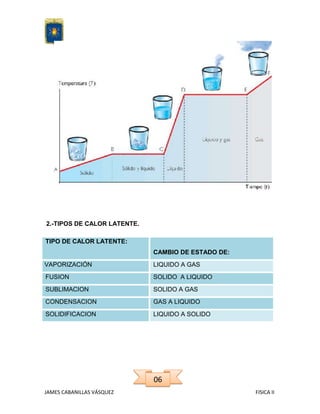
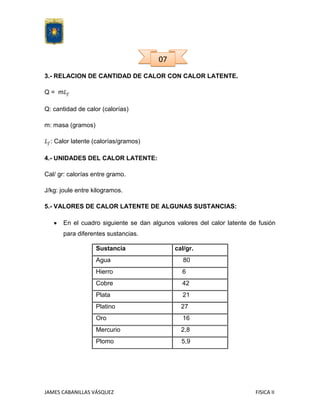
Este documento explica el concepto de calor latente y sus diferentes tipos como calor de evaporización, fusión, sublimación, etc. Define el calor latente como la energía necesaria para cambiar el estado de una sustancia sin cambiar su temperatura. Explica las unidades del calor latente y proporciona valores para diferentes sustancias. También muestra un ejemplo de cálculo para determinar la cantidad de calor necesaria usando el calor latente y el calor específico.