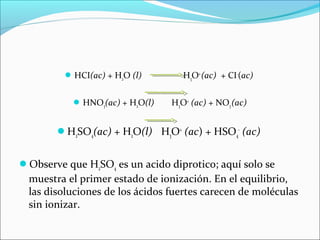
Este documento resume las propiedades del agua, incluyendo su capacidad para actuar como ácido o base dependiendo de su entorno. Explica que el agua se autoioniza en una pequeña proporción, formando iones hidronio e hidróxido. También define ácidos y bases fuertes y débiles, y explica que los ácidos y bases fuertes se ionizan completamente mientras que los débiles solo lo hacen parcialmente.







![Ácida: [H3O+] > [OH-]
Neutra: [H3O+] = [OH-]
Básica: [H3O+] < [OH-]](https://image.slidesharecdn.com/exposici-140511151818-phpapp01/85/Exposicion-acidos-y-bases-fuertes-y-debiles-8-320.jpg)









![Constante de ionización
Al igual que los ácidos, la reacción de las bases débiles con agua se puede
cuantificar con base en el valor de la CE de la reacción general:
B: + H2O BH- +
OH-
K= [BH+
][OH-
]
[B][H2O]
Kb= [BH+
][OH-
]
[B]
Constante de
ionización básica](https://image.slidesharecdn.com/exposici-140511151818-phpapp01/85/Exposicion-acidos-y-bases-fuertes-y-debiles-19-320.jpg)
