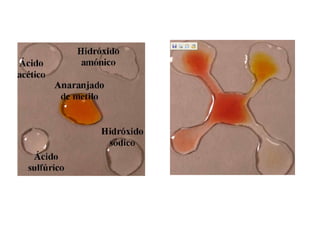
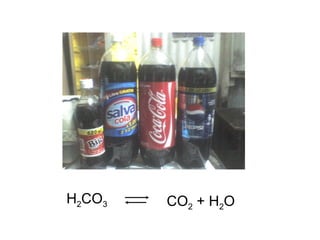
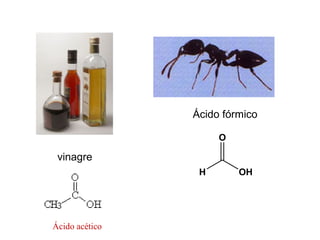
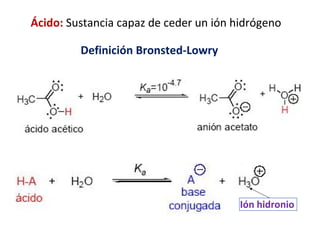
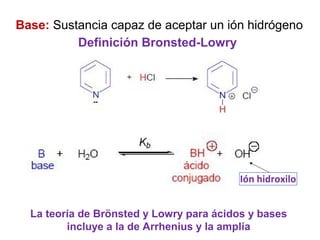
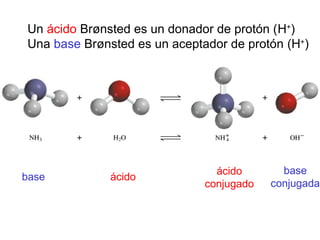
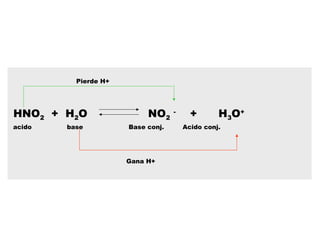
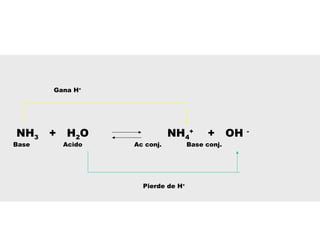
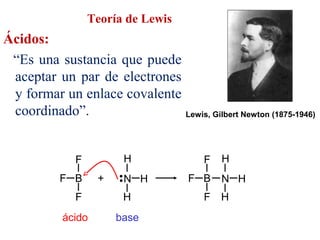
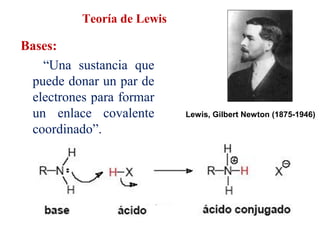
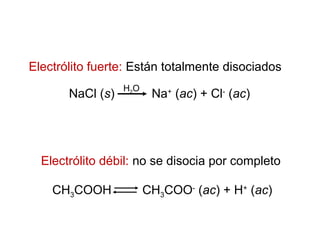
Este documento describe las teorías de Arrhenius, Brønsted-Lowry y Lewis sobre ácidos y bases. Explica que un ácido dona protones mientras que una base los acepta, y que siempre existe una pareja ácido-base conjugada. También cubre electrolitos fuertes y débiles, la escala pH, titulaciones ácido-base y soluciones tampón.









![AH H+
+ A- Ka = [H+
][A-
] / [AH]
Constante de disociación ácida
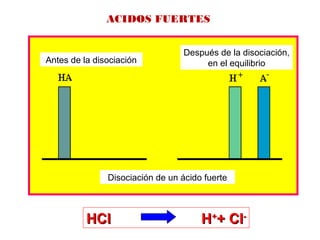
ACIDOS Y BASES DEBILES
Antes de la disociación
Después de la disociación,
en el equilibrio
Disociación de un ácido debil](https://image.slidesharecdn.com/acidosybases-180811180134/85/Acidos-y-bases-21-320.jpg)
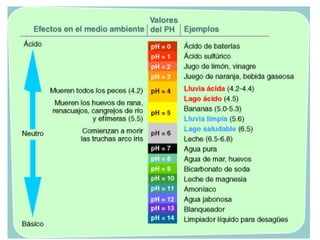
![El pH: una medida de la acidez
pH = -log [H+
]
[H+
] = [OH-
]
[H+
] > [OH-
]
[H+
] < [OH-
]
La disolución es
neutra
ácida
básica
[H+
] = 1 x 10-7
[H+
] > 1 x 10-7
[H+
] < 1 x 10-7
pH = 7
pH < 7
pH > 7
A 250
C
pH [H+
]
pH
7
ácida básica](https://image.slidesharecdn.com/acidosybases-180811180134/85/Acidos-y-bases-22-320.jpg)