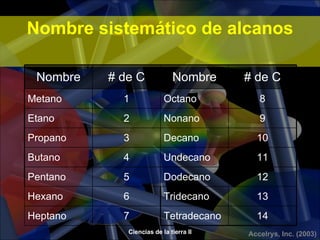
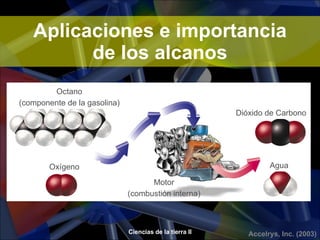
Los alcanos son hidrocarburos formados por carbono e hidrógeno que se caracterizan por tener enlaces covalentes simples. Son los principales componentes del petróleo y se clasifican según su fórmula general CnH2n+2. Los alcanos de cadena corta son gases o líquidos volátiles y los de cadena larga son sólidos a temperatura ambiente. Se usan como fuentes de energía, solventes y en la industria petroquímica.








![Bibliografía Educación Remota Operada por Software. (2003). Reacciones orgánicas básicas [Imagen]. Educación Remota Operada por Software. Recuperado el 27 de mayo de 2003 de la World Wide Web: http://eros.pquim.unam.mx/olimpiada/material/organica/reacciones.htm Accelrys, Inc. (2003). Material Studio Gallery [Imagen]. Accelrys, Inc. Recuperado el 27 de mayo de 2003 de la World Wide Web: http://www.accelrys.com/gallery/mstudio/methane.jpg](https://image.slidesharecdn.com/alcanos-1210895303219129-9/85/ALCANOS-11-320.jpg)
